琼脂糖凝胶电泳和醋酸纤维素薄膜电泳的条带出现跑带,拖带,多带以及其他可能出现的状况分别是什么原因啊
 木林黄昏2022-10-04 11:39:541条回答
木林黄昏2022-10-04 11:39:541条回答
琼脂糖凝胶电泳和醋酸纤维素薄膜电泳的条带出现跑带,拖带,多带以及其他可能出现的状况分别是什么原因啊
满意了可以再加分,十万火急啊,谢谢啦
满意了可以再加分,十万火急啊,谢谢啦

已提交,审核后显示!提交回复
共1条回复
 knightlan 共回答了29个问题
knightlan 共回答了29个问题 |采纳率93.1%- 能不能附上你跑完的凝胶图上来?
三个大的方面:
1.样品处理问题.样品纯度差,跑DNA电泳时有杂质蛋白污染(琼脂糖的话可以在紫外光下检查上样孔是否有白色亮团);样品上样前已有部分程度的降解(拖尾).
2.试剂问题.凝胶要配好一点(尽量用新鲜的试剂,新鲜配制后即电泳),胶的浓度把握到位. - 1年前
相关推荐
- 分析“大学生物化学、分子生物学-实验-紫外灯下的DNA琼脂糖凝胶电泳结果”
分析“大学生物化学、分子生物学-实验-紫外灯下的DNA琼脂糖凝胶电泳结果”
请对这张图进行分析

 mason01871年前1
mason01871年前1 -
 lhjz 共回答了12个问题
lhjz 共回答了12个问题 |采纳率83.3%这应该是对提取的DNA进行的电泳,上面亮的带是DNA,下面稍暗的是RNA
提取效果很好,DNA完整无弥散现象,RNA很少只需加少量酶去除.
但你这图片不太清楚,如果不是你照相的问题的话,我建议你该换电泳缓冲液了1年前查看全部
- DNA的琼脂糖凝胶电泳的应用和发展举例.要详细一点的.
 li12021年前1
li12021年前1 -
 jiaojunqi 共回答了17个问题
jiaojunqi 共回答了17个问题 |采纳率76.5%应用:
1、DNA的制备.
⑴ 适合分离大片段DNA.
琼脂糖凝胶约可区分相差100bp的DNA片段,其分辨率虽比聚丙烯酰胺凝胶低,但它制备容易,分离范围广,尤其适于分离大片段DNA.普通琼脂糖凝胶分离DNA的范围为0.2-20kb,利用脉冲电泳,可分离高达10^7bp的DNA片段.
在青贮饲料总DNA的提取实验中,是通过琼脂糖凝胶电泳和紫外吸收来实现的.所提取的DNA纯度较高,可直接用于下游分子操作,提取方法灵敏度高,能全面反映样品中的微生物原貌[1].
在“CTAB结合DNA凝胶回收试剂盒提取食用菌DNA”实验中,研究人员用了两种方法来提取DNA:一、CTAB法(对照法).二、CTAB与DNA凝胶回收试剂盒(琼脂糖凝胶DNA试剂盒)结合法(结合法).实验结果表明,与对照法相比结合法提取DNA样品的电泳条带更规则、清晰,且DNA的酶切效率显著高于对照.由此说明,结合法能高效地从富含多糖的材料中分离到纯净的DNA[2].
⑵ 可提取大分子DNA.
在“洋葱帕克霍尔德氏菌HMW·DNA的制备及酶切研究”的实验中提到,构建大片段基因组文库的关键就是获得高分子量的基因组DNA[3].而利用成熟的商品化试剂盒提取基因组DNA只能得到大小约在20kb左右的DNA;酶抽提法需经过多次抽提法才能得到较纯的DNA,但极易造成基因组断裂,也难以得到大于300kb的基因组DNA.两种方法均不能达到目的,但经过研究人员不懈的研究,利用琼脂糖凝胶制备成凝胶块提取基因组DNA能够获得足够大的DNA片段,可以完全符合构建粘粒基因组文库的要求.在此过程中研究人员在用低熔点琼脂糖还是普通熔点琼脂糖制备凝胶块的问题中选择了后者,因为低熔点琼脂糖价格昂贵且胶块在制备纯化的过程中容易断裂,而普通熔点琼脂糖与低熔点琼脂糖在基因组DNA制备方面没有区别.
1、PCR产物在琼脂糖凝胶上进行的电泳检测.
在基因组DNA的提取中,DNA经孵育及抽提、沉淀后以70%乙醇洗涤2次,再适量的双蒸水溶解DNA.然后在1.0%的琼脂糖凝胶上进行电泳,以1kb DNA ladder 为参照,估计DNA溶液浓度.具体检验方法是:2.0%琼脂糖制成凝胶,取6 微升 AFLP—PCR产物与1微升上样缓冲液混匀后上样,用1×TBE电泳缓冲液,120V电泳50min,使用EB溶液染色后在凝胶成像系统(ChampGel-3200)上观察拍照[4].
2、琼脂糖在其他方面的应用
⑴ 琼脂糖在免疫扩散法中的应用.
免疫扩散法就是利用琼脂糖凝胶作为扩散介质,使抗原与抗体在琼脂糖凝胶中自由扩散而相遇,从而形成抗原抗体复合物,由于此复合物分子量增大并产生聚集,不再继续扩散而形成肉眼可见的带状或线状沉淀带.抗原抗体复合物的沉淀带是一种特异性的半渗透性屏障,它可以阻止免疫学性质与其相似的抗原抗体分子通过,而允许那些性质不相似的分子继续扩散,这样由不同抗原或不同抗体所形成的沉淀带各有各的位置,从而可以分离和鉴定混合系统.
利用琼脂糖凝胶作为扩散介质是因为一定浓度的琼脂糖凝胶,其内部为多孔网状.而且孔径很大,可以允许大分子物质(分子量自十几万到几百万以上)自由通过.因为大多数抗原和抗体的分子量都在20万以上,所以它们在琼脂糖凝胶中几乎可以自由扩散.而且琼脂糖凝胶又具有良好的化学稳定性、含水量大、透明度好、来源方便、处理容易等优点,因此是免疫沉淀检测技术中最理想的扩散介质.
双向琼脂扩散实验中也用琼脂或琼脂糖作为扩散介质,原因同上.
⑵ 琼脂糖在双链DNA探针的合成方法中的作用.
双链DNA探针的合成方法主要有切口平移法和随机引物合成法.
a 切口平移法
影响切口平移反应的几种因素:(a) 产物的比活性取决于[α-32 P]dNTP的比活性和模板中核苷酸被置换的程度.(b) DNA酶Ⅰ的用量和E.coli DNA聚合酶的质量会影响产物片段的大小.(c) DNA模板中的抑制物如琼脂糖会抑制酶的活性,故应使用仔细纯化后的DNA.
b 随机引物合成法
随机引物合成法还可以在低熔点琼脂糖中直接进行.
以上是琼脂糖凝胶在生物学各个领域中的部分应用.但由于当今生物研究领域正处于飞速的发展之中,所以琼脂糖凝胶的应用范围可能会更广,会在生物研究中发挥自己应有的作用.
发展举例:琼脂、琼脂糖因为有特殊的胶凝性质,尤其有显著的稳固性、滞度和滞后性,并且易吸收水分,有特殊的稳定效应;已经广泛使用于食用、医药、化工、纺织、国防等领域,据不完全统计,琼脂、琼脂糖的用途已有1000多种,被国际上称为“新奇的东亚产品”.在食品工业中可用于生产:水晶软糖、定型软糖、水产品、肉类罐头、果汁饮料、果肉饮料、米酒饮料、乳品饮料、精品、乳品蛋糕.1年前查看全部
- 用试剂盒提取干种子壳DNA,提取出来跑0.8%的琼脂糖凝胶电泳,没有条带出现;
用试剂盒提取干种子壳DNA,提取出来跑0.8%的琼脂糖凝胶电泳,没有条带出现;
但将提取出的DNA,跑PCR,再跑1.5%的琼脂糖凝胶电泳,目的基因的条带出现且很明显,请问这是什么原因,怎么直接提取出来琼脂糖电泳检测没有条带出现? bjzrf1年前1
bjzrf1年前1 -
 一马春风 共回答了23个问题
一马春风 共回答了23个问题 |采纳率95.7%种子壳中的DNA含量是很少的,电泳不一定检测得到,而PCR就不同了,灵敏度很高(能放大千百万倍),最后能检测得到是很正常的了.
你能PCR检测得到,就说明基因组DNA提取成功了,不就管直接电泳的结果.
如果你非得让基因组能电泳检测得到,可以试着先大量提取,最后把提提的基因组DNA浓缩一下,也许得浓缩上十倍百倍或者更高的倍数才能电泳检测得到.1年前查看全部
- 如何确定PCR扩增产物分子量做PCR实验,产物琼脂糖凝胶电泳成像后得一条带,要求与mark对比确定扩增产物分子量.
 jnxwzk1年前1
jnxwzk1年前1 -
 唐朝汉朝 共回答了15个问题
唐朝汉朝 共回答了15个问题 |采纳率86.7%.
你自己不是已经回答了吗?
将PCR产物和Marker放在同一块胶里跑电泳(当然是加在两个加样孔中).Marker一般都有很多条带的,看你的产物在哪两条带之间,就可以估计了.当然也可以拍照后用软件分析,不过也是个估计而已.1年前查看全部
- 用琼脂糖凝胶电泳怎么检测DNA质量 什么是标准
 bananarase1年前2
bananarase1年前2 -
 tcws1031 共回答了31个问题
tcws1031 共回答了31个问题 |采纳率87.1%DNA如果降解或者混有其他杂质比如蛋白质、RNA的话,在电泳中可以检测的到.
线性的单一DNA样品一般是单条带,质粒的话可能会有2-3条带.
如果条带变宽、变暗、或者变成弥散的DNA条带,表示DNA非特异的降解.‘
如果条带变成多条,表示可能被酶切.如果质粒被单酶切,可能变成一条亮带.
如果有蛋白质污染,上样孔可能发亮.如果有RNA污染,可能小分子量部分会有弥散.
等等.
标准是电泳条带亮度.通过亮度可以粗略计算DNA条带的含量.如果DNA有损失,对应的条带会变暗或者消失1年前查看全部
- RNA在酒精中的溶解性怎样?RNA可以溶于酒精吗?如果提取大肠杆菌染色体DNA时混有RNA再做7%的琼脂糖凝胶电泳会有什
RNA在酒精中的溶解性怎样?
RNA可以溶于酒精吗?如果提取大肠杆菌染色体DNA时混有RNA再做7%的琼脂糖凝胶电泳会有什么影响? LutHi1年前4
LutHi1年前4 -
 787846 共回答了22个问题
787846 共回答了22个问题 |采纳率77.3%不能溶于酒精
提取中都是用酒精洗脱盐离子使DNA或RNA沉淀下来
本身是不溶于酒精的
混有RNA的话基本是没有影响的
因为RNA比DNA要跑的快
跑完后会在胶的最前段
而且残留的RNA很大部分因为无处不在的RNA酶而降解
所以基本没问题
还有就是跑琼脂糖不用7%的胶
除非是特定大小片段的回收
否则基本用0.8%或1%的琼脂糖做分离就好了1年前查看全部
- 琼脂糖凝胶电泳是什么?琼脂糖凝胶电泳是做什么用的?跑出来的带能看出什么?
 caoli_201年前1
caoli_201年前1 -
 oime 共回答了18个问题
oime 共回答了18个问题 |采纳率94.4%区分不同生物大分子的技术.
跑出来的条带表示具有不同质量、电量、构型的分子.电荷量越大、分子量越小、构型越紧凑,在电场中移动越快,就是跑得越远的带.
比如亲子鉴定,可以通过比对样品的条带相似度判断有无血缘关系.1年前查看全部
- 琼脂糖凝胶电泳请问电泳缓冲液为什么要没过凝胶面约1mm?另外,可以先加样再让电泳缓冲液没过胶面吗?
 mjzzaff31年前1
mjzzaff31年前1 -
 未到斋主 共回答了22个问题
未到斋主 共回答了22个问题 |采纳率86.4%其实就是必须让缓冲液没过胶而已
可能是为了凝胶的截面上的电场比较均匀把
先加样不太好,加缓冲液的时候,缓冲液进入加样孔,容易把点好的样品给冲出来1年前查看全部
- HBV DNA进行PCR扩增后的琼脂糖凝胶电泳拖尾非常严重的原因
HBV DNA进行PCR扩增后的琼脂糖凝胶电泳拖尾非常严重的原因
图片上的数字是标本号,每一个孔都是不同的标本,不是梯度PCR

 想要飞的雄1年前3
想要飞的雄1年前3 -
 AMG悍马 共回答了20个问题
AMG悍马 共回答了20个问题 |采纳率95%这个看上去像是你在做梯度PCR,所以有很多条带是弥散状的,你可以把比较清晰的条带回收回来,作为模板,利用你之前做梯度得到的优化后的PCR条件再进行一次PCR,看效果如何.
补充:这样的话,可能是你不同样本的模板质量不一样,所以有的P出来了,有的没有P出来.而且,这种从基因组上直接PCR的话,一般都会或多或少的有弥散的.1年前查看全部
- RNA琼脂糖凝胶电泳几个问题提取RNA后跑琼脂糖凝胶电泳,图像出现下列几种现象都分别可能是哪些原因造成的啊.1.整个条带
RNA琼脂糖凝胶电泳几个问题
提取RNA后跑琼脂糖凝胶电泳,图像出现下列几种现象都分别可能是哪些原因造成的啊.
1.整个条带不清晰
2.根本没有条带
3.18s很淡,但是28s却很亮.也就是说亮度远不止两倍.
4.条带拖尾严重
5.18s和28s的亮度差不多
请给个说明和原因.最好能有出处. joeyhsia1年前4
joeyhsia1年前4 -
 oo翅膀 共回答了16个问题
oo翅膀 共回答了16个问题 |采纳率81.3%RNA跟DNA不一样,主要现象就是降解
1.提取过程中RNA出现降解
2.洗脱的时候洗掉了
3.18S有部分降解
4.弥散带说明降解严重,杂质过多
5.28S部分降解
RNA完美提出来的话应该是三条带:28,18,5.8
28和18比较亮
而且28是18的2倍量
5.8基本很模糊
可有可无1年前查看全部
- 琼脂糖凝胶电泳用哪种琼脂糖 DNA线性长度如何确定
 sickbaby1271年前2
sickbaby1271年前2 -
 碧海晴雨 共回答了19个问题
碧海晴雨 共回答了19个问题 |采纳率84.2%sigma公司生产的琼脂糖比较多人用,质量也比较好,线性DNA长度可以琼脂糖凝胶电泳来判断呀,这要看你的DNA是多大的了,如果是几KB的话,选择相应的Marker,跑电泳比对一下就知道大小了,如果是10KB以上的话,先用内切酶切,然后再跑电泳比对带型1年前查看全部
- 帮忙分析一下这张琼脂糖凝胶电泳图啊
帮忙分析一下这张琼脂糖凝胶电泳图啊
这是我昨天提完质粒后做检测的一张图,一共十六个样,没点maker,其中最左边两个点样孔没有点样.谁能帮忙分析一下为什么最左边两个孔没点样也会发亮啊?还有那十六个样只有两个跑出来了,其他都没有是为什么啊?都会有什么原因?做的胶是没有问题的,也排除质粒没有提出来的因素~
这是转化后提的质粒……
 晚风吹1年前4
晚风吹1年前4 -
 怜幽草 共回答了16个问题
怜幽草 共回答了16个问题 |采纳率93.8%就是没有提出来,你可以用紫外风光光度计测一下你所提治理的260,看看有没有东西就知道了.1年前查看全部
- DNA琼脂糖凝胶电泳的loading buffer作用是?
DNA琼脂糖凝胶电泳的loading buffer作用是?
6*的一定要稀释成1*的使用吗? 655rfdvvv1年前3
655rfdvvv1年前3 -
 tt闯天下 共回答了21个问题
tt闯天下 共回答了21个问题 |采纳率76.2%作用:使DNA粘度增大,不要再点样中被漂离凝胶; 加入的指示剂 可指示前沿.
1*的浓度 是个经验.浓度太大,可能产生 DNA和buffer中物质难以分开,拖带;指示剂前沿太宽等 适当增加浓度 没问题,但没必要.1年前查看全部
- 核酸琼脂糖凝胶电泳时电压一般为多少
 马儿12341年前1
马儿12341年前1 -
 snplingli 共回答了10个问题
snplingli 共回答了10个问题 |采纳率100%120V,越高跑的越快,但是跑出来的效果会差一些.我一般都是120V跑的,跑多久看你要分出来的带多大,条带之间大小差多少.1年前查看全部
- 琼脂糖凝胶电泳样品和mark都不清楚 为什么
 一路终点1年前2
一路终点1年前2 -
 asetqwtqw 共回答了23个问题
asetqwtqw 共回答了23个问题 |采纳率87%如果MARK也不清楚,就是跑胶的问题了,是不是拖尾?如果只是萤光很淡,那么是点样浓度的问题.如果拖尾,可能有以下4种情况:(1)电泳缓冲液TAE或者TBE的污染,建议更换缓冲液.(2)上样时样品漂了,建议增加上样缓冲液的用量,以及小心加样.(3)电压太高.(4)适当把你的胶的浓度加大.(根据你的片断大小而定)1年前查看全部
- 电泳速度与DNA构象的关系质粒DNA通常具有三种不同的构象:共价闭合环状、线型、开环型.琼脂糖凝胶电泳时,一般共价闭合环
电泳速度与DNA构象的关系
质粒DNA通常具有三种不同的构象:共价闭合环状、线型、开环型.琼脂糖凝胶电泳时,一般共价闭合环状的迁移速度最快,其次为线状分子,开环型分子最慢,为什么呢?
已知三者的核苷酸数相同.
主要是线型和开环型的比较.(线型和开环型相比,谁的分子结构更紧凑,为什么?) qo3lwg1年前1
qo3lwg1年前1 -
 bingyu 共回答了15个问题
bingyu 共回答了15个问题 |采纳率86.7%取决于分子量大小和体积
分子量小体积小的物质电泳迁移速度快 这个是学生化的常识啊
共价闭合环状DNA结构紧凑 体积小 所以最快
同理 其次为线装 开环
线状你应该可以理解
我主要说说开环 开环就是双链DNA中的其中一条链短裂 然后此时的DNA分子就会变成环状分子 变成一大团东西 此时的体积就比线状大很多了 所以开环速度最慢1年前查看全部
- 琼脂糖凝胶电泳时如果提取的DNA中含有蛋白质和RNA污染应如何解决?
 menglideniwangyu1年前1
menglideniwangyu1年前1 -
 还济洛川北 共回答了17个问题
还济洛川北 共回答了17个问题 |采纳率82.4%蛋白污染可以考虑用酚氯仿多抽提几次,记得吸上清的时候小心点,宁可浪费也别吸到界面.一般后续还需要用氯仿/异戊醇抽提来去除酚.这样基本蛋白污染就可以去干净.实在不行,抽提一次后,就用蛋白酶K消化30min,再抽提.
如果DNA多,RNA污染就添加RNase A消化,你可以中途取少量跑胶检测,RNA去干净了再抽提,再沉淀DNA.1年前查看全部
- 如何通过琼脂糖凝胶电泳分开两个大小只差50bp左右的片段?
如何通过琼脂糖凝胶电泳分开两个大小只差50bp左右的片段?
在做双酶切,想回收目的片断.目的片断2776bp,载体2710bp,双酶切后60V,1.0%琼脂糖凝胶跑了90min分不开,可以看见3000bp以下很亮的一条带.请高手指点如何分开大小这么相近的片段. 62hf1年前3
62hf1年前3 -
 烸鸣 共回答了18个问题
烸鸣 共回答了18个问题 |采纳率94.4%这两个片段太接近了,通过琼脂糖胶很难分开.建议再用一个载体上有的酶,而目的片段上没有的酶来切一下,也就是做个三酶切,这样载体片段就被切断了.1年前查看全部
- 碱裂解法提取的质粒DNA琼脂糖凝胶电泳应该是什么样的?
 jade10011年前2
jade10011年前2 -
 leetaotao 共回答了11个问题
leetaotao 共回答了11个问题 |采纳率90.9%一般都有3条带.据推测跑在最前边的是cccDNA(共价闭合环),中间的是OC(开环),最后的有点拖带,稍宽,早期多认为是线状的,但后来专家认为断链质粒发生几率很低,形不成条带,因此现在一般认为是处于复制过程中的1.5倍左右的条带.
以上均为推测,每人真的去证明.
但若将质粒提取液单酶切,将会得到整齐的一条带.我实验室经常用这种方法估计质粒的纯度.1年前查看全部
- 琼脂糖凝胶电泳的原理什么
 teateacat1年前1
teateacat1年前1 -
 糖果婴儿 共回答了21个问题
糖果婴儿 共回答了21个问题 |采纳率85.7%琼脂糖凝胶电泳是用琼脂糖作支持介质的一种电泳方法.其分析原理与其他支持物电泳的最主要区别是:它兼有“分子筛”和“电泳”的双重作用.
琼脂糖凝胶具有网络结构,物质分子通过时会受到阻力,大分子物质在涌动时受到的阻力大,因此在凝胶电泳中,带电颗粒的分离不仅取决于净电荷的性质和数量,而且还取决于分子大小,这就大大提高了分辨能力.但由于其孔径相当大,对大多数蛋白质来说其分子筛效应微不足道,现广泛应用于核酸的研究中.
DNA分子在琼脂糖凝胶中泳动时有电荷效应和分子筛效应.DNA分子在高于等电点的pH溶液中带负电荷,在电场中向正极移动.由于糖-磷酸骨架在结构上的重复性质,相同数量的双链DNA几乎具有等量的净电荷,因此它们能以同样的速率向正极方向移动.1年前查看全部
- 如果PCR扩增实验中PCR产物在琼脂糖凝胶电泳试验中有条带,但是很浅,应该调整那些条件.
 jinhewansheng1年前4
jinhewansheng1年前4 -
 iceweier 共回答了23个问题
iceweier 共回答了23个问题 |采纳率87%尝试其他退火温度...有人提了,我就不重复了.
如果没有非特异性条带,可以取4-5ul产物,直接作模板进行2次PCR..1年前查看全部
- 琼脂糖凝胶电泳时,琼脂糖的浓度为2%,胶不凝是怎么回事啊?还要继续增大琼脂糖的浓度吗?
琼脂糖凝胶电泳时,琼脂糖的浓度为2%,胶不凝是怎么回事啊?还要继续增大琼脂糖的浓度吗?
我见书上说2%的浓度做出来的胶很硬了,可我按这个浓度做的胶却不能拿,一动就烂.. abuq1年前1
abuq1年前1 -
 苹果酸了又甜 共回答了17个问题
苹果酸了又甜 共回答了17个问题 |采纳率94.1%一般来说1%的浓度就够了,如果你的样品分子量比较大,可以用2%的,浓度越大,胶越硬.你做的胶不能拿,用的是TBE缓冲液吗?配完后,需要加热至沸腾,然后再冷却.还有,你用的是琼脂粉还是琼脂糖?做胶用琼脂糖,配培养基用琼脂粉.1年前查看全部
- 质粒DNA双酶切后进行琼脂糖凝胶电泳检测为什么没有出现条带 质粒DNA双酶切琼脂糖凝胶电泳检测为什么没%
 华木1年前3
华木1年前3 -
 抱着被子睡觉 共回答了20个问题
抱着被子睡觉 共回答了20个问题 |采纳率100%补充一点就是看看你的片段是否有这个酶的酶切位点.尽管有些好笑,但是有人确实犯过这样的错误.你提取的质粒浓度很低的话,在酶切的时候就少加点水多加点质粒.不然浓度低当然看不见.1年前查看全部
- 琼脂糖凝胶电泳中凝胶的配方!要最常用的那个配方!顺便说说比例关系!
 iq-iq1年前1
iq-iq1年前1 -
 cwy1118 共回答了18个问题
cwy1118 共回答了18个问题 |采纳率100%最常用1%的,称取琼脂糖1g,加100ml电泳缓冲液(TAE),微波炉煮沸,冷却到50度时倒胶.1年前查看全部
- 琼脂糖凝胶电泳、染色完毕后,紫外下成像为什么会有大片如撒了洗衣粉般的白色粉末形成的如地图状的杂质?
琼脂糖凝胶电泳、染色完毕后,紫外下成像为什么会有大片如撒了洗衣粉般的白色粉末形成的如地图状的杂质?
备注:胶面绝对干净,染色完毕后曾用蒸馏水洗过胶面,可见光下胶面很干净,无任何杂质。另外可保证绝不是胶放在底板上因气泡产生。本人做16S酶切,像此类情况已出现多次,一旦出现,只能返工,很费功夫。 vivky1年前1
vivky1年前1 -
 _duitu_ 共回答了14个问题
_duitu_ 共回答了14个问题 |采纳率78.6%可能是琼脂糖不太好,导致EB在某些地方聚集,从而产生你所说的背景.当然可能也和Buffer有关.1年前查看全部
- 琼脂糖凝胶电泳使用什么染色?需要注意什么问题?
 lingrain1年前2
lingrain1年前2 -
 makbudex666666 共回答了17个问题
makbudex666666 共回答了17个问题 |采纳率94.1%琼脂糖凝胶电泳的染料有许多种,近几年较常用的有:
EB-溴乙锭,EB有较大毒性,可致癌,所以使用时一定要万分小心.EB染色的背景较强.
SYBR Green--也叫荧光绿如蓝,低毒性,但检测灵敏度没有EB高.
GelRed--号称无毒,无皮肤渗入型,有伤口就不好说了.背景荧光弱,但加多了容易出现拖带.由于在市场上价格较高,所以有出现很多仿冒货,买时要擦亮眼睛.1年前查看全部
- 做琼脂糖凝胶电泳时,怎样使目的条带更清晰?
 公克1年前1
公克1年前1 -
 彭转转157 共回答了24个问题
彭转转157 共回答了24个问题 |采纳率79.2%那要看你的目的基因具体的来源,大小级别的特性.TAE和别的缓冲液什么的,也有些影响,还有就是胶浓度,跑胶时候的电压控制什么的.1年前查看全部
- (急)琼脂糖凝胶电泳后,走过的地方全都有荧光了,为什麼?
(急)琼脂糖凝胶电泳后,走过的地方全都有荧光了,为什麼?
今天做了两次琼脂糖凝胶电泳,第一次以为是点样不好引致DNA都四处跑了
可是第二次很小心地点样后还是这样
电泳完后拿到紫外灯下看
发现整块胶都有荧光了,包括点样处近负极不会跑电泳的那边都有
然后只有MARKER的带有很清楚的条带
为什麼会这样? hawa21年前3
hawa21年前3 -
 zero-guozi 共回答了15个问题
zero-guozi 共回答了15个问题 |采纳率86.7%电泳缓冲液太长时间没有更换,导致其中的核酸分子迁移进入你的凝胶从而使得本底荧光水平升高,建议更换电泳缓冲液后重新进行电泳.1年前查看全部
- DNA,质粒的琼脂糖凝胶电泳及PCR结果图分析
DNA,质粒的琼脂糖凝胶电泳及PCR结果图分析
这是DNA、质粒的跑胶图
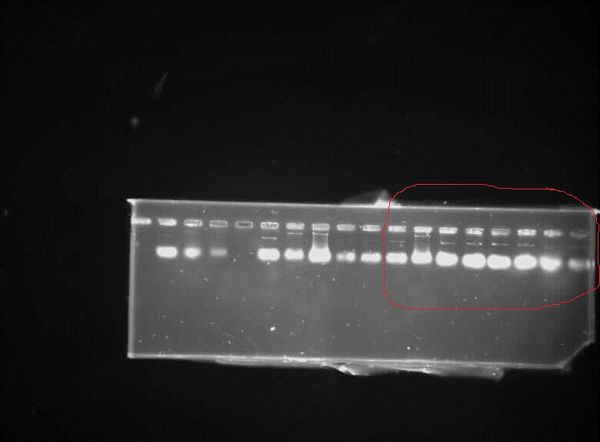
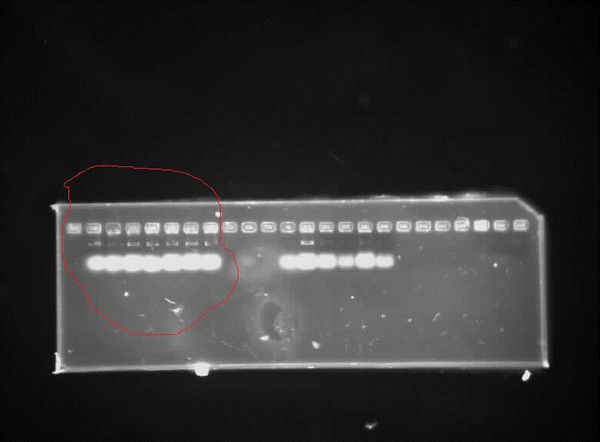
这是PCR扩增的图
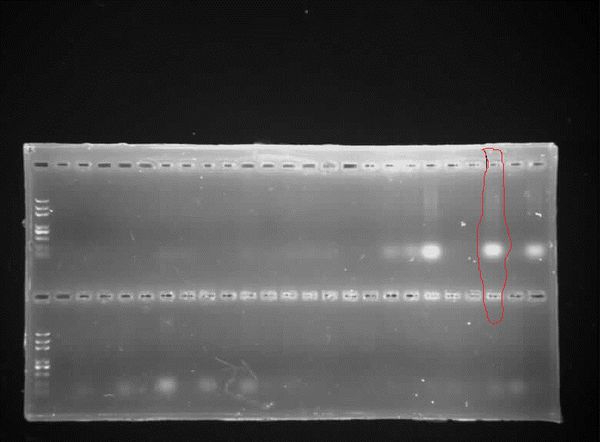
请分析以上红线圈出来的带,迫切需要,谢谢大家了
上图跑胶的第一个是质粒,第二个是DNA,可以随便找一条带分析就行 黔之老老驴1年前1
黔之老老驴1年前1 -
 妮宝贝 共回答了12个问题
妮宝贝 共回答了12个问题 |采纳率91.7%你这第一块是DNA 第二块是质粒?怎么都有两条带?而且看你PCR结果基本没有扩出来啊,也不知道你要问什么问题.1年前查看全部
- 琼脂糖凝胶电泳的DNA为什么要酶切
琼脂糖凝胶电泳的DNA为什么要酶切
我查文献,看到有些文献上提取质粒DNA,进行双酶切后才进行琼脂糖凝胶电泳,我的实验是提取小鼠的成纤维细胞的DNA后,对抑制因子Smad7进行重亚硫酸盐修饰的PCR,然后琼脂糖凝胶电泳,是不是我的DNA不需要酶切就可以跑胶?我不太明白为什么质粒DNA要酶切后电泳 ojw199991年前3
ojw199991年前3 -
 tuma 共回答了16个问题
tuma 共回答了16个问题 |采纳率93.8%呃,简单地说,质粒DNA酶切是因为我们之前在质粒上插入了一些目的片段,将质粒转到细菌里,细菌繁殖,再抽繁殖后的细菌里的质粒,就可以得到大量的含有目的片段的质粒,但我们要的是目的片段,质粒上的其他东西要去掉才行,所以要酶切,把我们要的片段切下来,可是切后目的片段与质粒其他片段混在一起,就要电泳把它们分开,把目的片段条带处的胶切下来,纯化,就得到大量的目的片段了.当然,也可以用此方法判断你的目的片段是不是正确插入质粒了.
不知道你具体想干什么,不过感觉你的目的是鉴定成纤维细胞DNA中某一基因的表达情况,那就和酶切无关了,至少和我上面说的那种酶切无关.
Good luck~1年前查看全部
- PCR,将引物原液做琼脂糖凝胶电泳,一般点样用多大量
PCR,将引物原液做琼脂糖凝胶电泳,一般点样用多大量
还有我的引物有22对碱基,要跑胶的话,琼脂糖凝胶应作成百分之几的?我看资料上讲检验正反引物的浓度,用引物原液做琼脂糖凝胶电泳。 nickoal1年前4
nickoal1年前4 -
 a4sdq2t23nt 共回答了24个问题
a4sdq2t23nt 共回答了24个问题 |采纳率91.7%1%的就可以,marker要有小的 否则容易跑出胶1年前查看全部
- 请问琼脂糖凝胶电泳时电压与电流的设置,怎么设置了电压,但总是打不到设定值,
请问琼脂糖凝胶电泳时电压与电流的设置,怎么设置了电压,但总是打不到设定值,
要想达到设定值就要加大电流,但这会使电泳仪发热,请问怎么解决? 狼桥遗梦1年前1
狼桥遗梦1年前1 -
 dewly 共回答了17个问题
dewly 共回答了17个问题 |采纳率94.1%电泳发热很正常,不过千万别把胶给热化了.如果你不放心,可以把电压调小一些,没必要一定用规定的电压跑电泳.电压小一点,无非跑得时间长一些,不影响结果.1年前查看全部
- 琼脂糖凝胶电泳实验失败原因?实验首先是用PCR扩增DNA片段,然后用琼脂糖凝胶电泳分析PCR产物的量,结果失败了,EB染
琼脂糖凝胶电泳实验失败原因?
实验首先是用PCR扩增DNA片段,然后用琼脂糖凝胶电泳分析PCR产物的量,结果失败了,EB染色后凝胶上没有出现亮带.请教各位牛人这些步骤里面可能出现问题的在哪里? 傻瓜6661年前3
傻瓜6661年前3 -
 cns1ck 共回答了21个问题
cns1ck 共回答了21个问题 |采纳率90.5%可能性太多了.
1.你跑胶一般都要放MARKER或者叫DNA LADDER吧,这个MARKER除外对DNA标记大小以外,还可以用来监控ELECTROPHORESIS的质量,如果MARKER显示而DNA没显示,说明ELECTROPHORESIS正常而DNA有问题,如果MARKER和DNA都没有显示,说明是你的电永出现了问题.
ELECTROPHORESIS的可能问题有,1.ELECTROPHORESIS BUFFER浓度问题,2.BUFFER太陈旧了从而失效 3.跑过了(根据SIZE来看)
2.如果证明是DNA复制也就是PCR的问题,可能性就太多了.
具体包括你所使用的PCR
BUFFER:浓度问题(需要1X),盐析问题(有时候放置太久其中的SALT会析出,溶解不透彻就会失效),氯化镁浓度问题.
DDNTP:浓度问题(可能配得浓度不够),陈旧性问题.
TAQ:你的酶有可能失效.
PRIMER问题:你的PRIMER可能NOT WORK.也可能你的ANNEALING TEM有问题,初次使用PRIMER的时候建议作温度的GRADIANT TEST,测试最佳ANNEALING TEM.PRIMER也可能太陈旧了,浓度或高或低.PRIMER容易行程DIMER.
PCR PROGRAMME的设置问题:这个最简单,建议仔细过一遍.
总之,如果是PCR的问题,建议每次保持其他不变,只改变其中的一项来把问题找出来,另外提醒你最好要作POSITIVE 和NEGATIVE CONTROL.1年前查看全部
- 琼脂糖凝胶电泳分离DNA 图谱分析
琼脂糖凝胶电泳分离DNA 图谱分析
琼脂糖凝胶电泳分离DNA图谱中,出现3条带,跑得快那条很亮,如何解释 coolerkk1年前4
coolerkk1年前4 -
 YMXX169SXJ 共回答了14个问题
YMXX169SXJ 共回答了14个问题 |采纳率78.6%你给的信息的确很少了.
楼上2位都分析的很好,不过,我补充说一下 露姬雅 关于质粒三条带的解释.现在对于3条带的解释是这样的:最前面跑最快的是超螺旋,质粒是超螺旋的,你电泳的时候最亮很正常;中间的是开环质粒(由于在提取质粒中物理机械力把质粒打断了);最后是质粒的复制中间体(即没有完全复制的2个质粒连在一起).可以想象后2者量很少,所以电泳带不亮.
如果不是质粒电泳,只是普通DNA,根据你提供的信息,没有什么可以解释的,只是说明跑的最快的DNA含量最大,其他2条可能是杂带1年前查看全部
- 琼脂糖凝胶电泳问题请问做ISSR-PCR琼脂糖凝胶电泳一般使用多大浓度的胶.
 xgwhj1年前1
xgwhj1年前1 -
 村樵 共回答了19个问题
村樵 共回答了19个问题 |采纳率94.7%看你扩增的DNA片段多大?如果是900到几千的,用1.2%—3%的.自己看看,差不多的浓度就可以.轻微的浓度差异没什么问题 胶的浓度越高,跑的越慢1年前查看全部
- 我想用琼脂糖凝胶电泳来测酶的分子量差不多300KD,想请问一下,该凝胶的浓度要怎么确定.
 可剁1231年前1
可剁1231年前1 -
 公式dd 共回答了19个问题
公式dd 共回答了19个问题 |采纳率100%做蛋白电泳应该用聚丙烯酰胺凝胶电泳吧1年前查看全部
- 在做琼脂糖凝胶电泳时,如果胶的浓度不合适,会发生什么情况
 tianfu18991年前1
tianfu18991年前1 -
 liuweizyh 共回答了31个问题
liuweizyh 共回答了31个问题 |采纳率90.3%一般要根据要电泳分离的核酸的分子量大小:分子量大的核酸电泳时使用浓度较小的凝胶,分子量小的核酸电泳时使用浓度较大的凝胶.核酸在浓度越大的凝胶中电泳速度越小.如果胶浓度偏高,可能跑不动,如果胶浓度偏低,可能跑得太快,分不开.
可以查到核酸分子大小与琼脂糖浓度范围的对应关系.1年前查看全部
- SDS法提取植物基因组DNA经琼脂糖凝胶电泳中间有带的原因有哪些
 he1ay1年前2
he1ay1年前2 -
 素手惜惜 共回答了21个问题
素手惜惜 共回答了21个问题 |采纳率85.7%提取过程中操作不当造成基因断裂,或有其他干扰性DNA成分,操作时的污染造成1年前查看全部
- 如何用琼脂糖凝胶电泳测定DNA片段大小?其根据是什么?
 画皮女妖1年前2
画皮女妖1年前2 -
 洛亚e3 共回答了11个问题
洛亚e3 共回答了11个问题 |采纳率90.9%步骤:
1.制备1%琼脂糖凝胶(大胶用70ml,小胶用50ml):称取0.7 g(0.5 g)琼脂糖置于锥形瓶中,加入70 ml(50ml)1×TAE,瓶口倒扣小烧杯.微波炉加热煮沸3次至琼脂糖全部融化,摇匀,即成1.0%琼脂糖凝胶液.
2.胶板制备:取电泳槽内的有机玻璃内槽(制胶槽)洗干净,晾干,放入制胶玻璃板.取透明胶带将玻璃板与内槽两端边缘封好,形成模子.将内槽置于水平位置,并在固定位置放好梳子.将冷却到65℃左右的琼脂糖凝胶液混匀小心地倒入内槽玻璃板上,使胶液缓慢展开,直到整个玻璃板表面形成均匀胶层.室温下静置直至凝胶完全凝固,垂直轻拔梳子,取下胶带,将凝胶及内槽放入电泳槽中.添加 1×TAE电泳缓冲液至没过胶板为止.
3.加样:在点样板或parafilm上混合DNA样品和上样缓冲液,上样缓冲液的最终稀释倍数应不小于1X.用10 ul微量移液器分别将样品加入胶板的样品小槽内,每加完一个样品,应更换一个加样头,以防污染,加样时勿碰坏样品孔周围的凝胶面.(注意:加样前要先记下加样的顺序).
4.电泳:加样后的凝胶板立即通电进行电泳,电压60-100V,样品由负极(黑色)向正极(红色)方向移动.电压升高,琼脂糖凝胶的有效分离范围降低.当溴酚蓝移动到距离胶板下沿约1cm处时,停止电泳.
5.电泳完毕后,取出凝胶,用含有0.5 ug/ml的溴化乙锭1×TAE溶液染色约20 min,再用清水漂洗10 min.
6.观察照相:在紫外灯下观察,DNA存在则显示出红色荧光条带,采用凝胶成像系统拍照保存.
原理:
借助琼脂糖凝胶的分子筛作用,核酸片段因其分子量或分子形状不同,电泳移动速度有差异而分离.1年前查看全部
- 琼脂糖凝胶电泳操作应注意哪些环节
 米草的故事1年前1
米草的故事1年前1 -
 绝对真实 共回答了25个问题
绝对真实 共回答了25个问题 |采纳率80%1.根据片段大小配制不同浓度的胶(改变分辨率),片段越小,需要胶浓度越大.
2.胶要现制先用
3.选择合适的Marker
4.配胶的缓冲液与电泳缓冲液要是同一种,且浓度一致(1倍)
5.点样时要加入loading buffer,并注意,不要将样点到点样孔之外(飘样),也不要将胶戳漏(漏样)
6.根据片段大小,及电泳检测目的,选择合适的电压及电泳时间
7.EB染色.可选择制胶时加入EB(要在溶玩胶后,且温度至室温时(用手握住制胶容器,不烫手即可));或电泳结束后,将胶放入EB溶液中染色.1年前查看全部
- 琼脂糖凝胶电泳时 marker需要点荧光染料吗?
 wanhuihui1年前2
wanhuihui1年前2 -
 beihaijingwang 共回答了17个问题
beihaijingwang 共回答了17个问题 |采纳率94.1%取决于几点:
楼主的marker本身有没有带有荧光染料.我用过的,如promega,都没有.
楼主的凝胶中有没有添加荧光染料.
楼主是否打算用在缓冲液中添加荧光染料的办法来染色.
如果都没有的话,楼主恐怕需要给它点荧光染料.1年前查看全部
- PCR扩增实验之后,产物用琼脂糖凝胶电泳,为什么看不到光带?添加试剂没有问题
 yizhi11年前5
yizhi11年前5 -
 chenchen0099 共回答了10个问题
chenchen0099 共回答了10个问题 |采纳率100%实验有没有跑标准分子量DNA Marker?如果Marker电泳后条带正常,那么就是PCR无扩增条带;如果Marker也看不见,那就是配胶有问题,或者配胶用的试剂(比如染料)有问题1年前查看全部
- 做琼脂糖凝胶电泳时,为什么琼脂糖要煮沸3次?
 平凡也要快乐1年前2
平凡也要快乐1年前2 -
 lytk 共回答了17个问题
lytk 共回答了17个问题 |采纳率88.2%去除溶解其中的气体,出现气泡会干扰洗脱顺序.(至于为何三次,不知)1年前查看全部
- 在DNA marker5000下,质粒pMD-18T DNA 跑琼脂糖凝胶电泳,结果在超过5000bp处有两条带,这是怎
在DNA marker5000下,质粒pMD-18T DNA 跑琼脂糖凝胶电泳,结果在超过5000bp处有两条带,这是怎么回事,求指教!
 ccckoisk1年前1
ccckoisk1年前1 -
 暗地女子 共回答了22个问题
暗地女子 共回答了22个问题 |采纳率95.5%超螺旋和线性呗 挺正常的1年前查看全部
- 核酸琼脂糖凝胶电泳看不见发光亮带 就连Dmark都不是发光的 在成像系统中 一片漆黑 调对比度 才能很艰难的看到白背景的
核酸琼脂糖凝胶电泳看不见发光亮带 就连Dmark都不是发光的 在成像系统中 一片漆黑 调对比度 才能很艰难的看到白背景的黑条带 与平时看见的黑背景发荧光的亮条带正好相反 请问是什么原因 染色剂用的Genefinder 这几天就在也做不出来过 药品什么的都和原来一样 问题很是棘手 我肯定不吝啬金币 只要你的答案对我有帮助
 人可草利101年前3
人可草利101年前3 -
 绿野枫叶红 共回答了13个问题
绿野枫叶红 共回答了13个问题 |采纳率92.3%你用肉眼在观察口看一看,如果看到有亮带,而仪器没显出来,应该是你的仪器被人给调了.滤波片波长等.
如果观察口看不到亮带,有可能是你那个染料出问题了.有些染料-20度保存的,反复冻融也会失效的.1年前查看全部
- 琼脂糖凝胶电泳DNA最少要加多少
 zjl00071年前1
zjl00071年前1 -
 yjjx 共回答了19个问题
yjjx 共回答了19个问题 |采纳率78.9%这是根据的DNA的浓度决定的,你的DNA的浓度大的话,你可以少上一点,DNA的浓度小的话,你
可以多上一点,一般我们上3-5微升就可以,就能检测到了,你要是照胶需要图片的话,你可以先少上点,看看情况,再做调整.1年前查看全部
- 质粒DNA琼脂糖凝胶电泳图分析其他组在比较明显的条带下能看到另一条比较浅的,为什么我的没有啊,而且上面的有一些变形了,怎
质粒DNA琼脂糖凝胶电泳图分析
其他组在比较明显的条带下能看到另一条比较浅的,为什么我的没有啊,而且上面的有一些变形了,怎么回事啊 chenhanqiu1年前1
chenhanqiu1年前1 -
 赵璟 共回答了14个问题
赵璟 共回答了14个问题 |采纳率92.9%那是他们提取的时候变性时间太长,变性的质粒DNA电泳的时候走在超螺旋DNA的前面,染色较淡.
变形的原因通常是上样量太大,也有可能是凝胶、缓冲液的原因.1年前查看全部
- 在PCR扩增产物的琼脂糖凝胶电泳实验中,如何知道所观察的样品在电泳过程中的大概位置
 今天看了1年前1
今天看了1年前1 -
 speedis11 共回答了15个问题
speedis11 共回答了15个问题 |采纳率66.7%看溴酚蓝作为指示,溴酚蓝大概跟250bp的条带位置差不多,如果你的条带长度短于250bp,那么溴酚蓝跑到胶的一半长度就可以拍照了;如果你的条带长度大于250bp,那么溴酚蓝跑到胶的三分之二或者四分之三位置就可以拍照了.主要看你经验,多跑几次就有感觉了.1年前查看全部
- 1%琼脂糖凝胶电泳中所需的溶液,以及配制
 彭南曙1年前1
彭南曙1年前1 -
 蹇驴嘶 共回答了27个问题
蹇驴嘶 共回答了27个问题 |采纳率81.5%电泳缓冲液一般是1×TAE或者0.5×TBE
TAE一般配制成50×的储存液
组分浓度2M Tris-醋酸,100mM EDTA
配制方法:
1.称量Tris 242g,Na2EDTA·2H2O 37.2g于1L烧杯中;
2.向烧杯中加入约800ml去离子水,充分搅拌均匀;
3.加入57.1ml的冰醋酸,充分溶解;
4.加去离子水定容至1L后,室温保存.
TBE一般配制成10×的储存液
组分浓度890mM Tris-硼酸,20mM EDTA
配制方法:
1.称量Tris 108g,Na2EDTA·2H2O 7.44g,硼酸 55g于1L烧杯中;
2.向烧杯中加入约800ml去离子水,充分搅拌均匀;
3.加去离子水定容至1L后,室温保存.1年前查看全部
大家在问
- 1答案为什么是c不是b 当c的值不为0时,在下列选项中能正确将c的值赋给变量a、b的是A) c=b=a; B) (a=c)
- 2某同学家有一40瓦的彩电,两只30瓦的日光灯,一台120瓦的冰.
- 316°23′10″-8°17′54″=
- 4设ξ1,ξ2是方阵A的属于不同特征值 λ1,λ2的特征向量,证明ξ1+ξ2不是A的特征向量.(用反证法证明)
- 50.25时等于多少分?
- 6一辆重力为3×104N的小汽车在水平地面上匀速行驶,已知汽车受到的牵引力是车重的0.2倍,求汽车受到的摩擦力和方向.并用
- 7这个怎么解甲在2015年 12月1日有45000元的债务需要归还在年利率百分10 一年复利一次情况下计算 下列指标 归还
- 8下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
- 9世界上最可怕的事答对给100
- 10六下语文习作四实验结果是啥?要写作文,不知道就别瞎回答.
- 11java编程实现如下问题:列出1 至100000 内,所有与数字7 具有关系的数.和7 有关
- 12以...用英语怎么说比如翻译下 以80kph的速度
- 13最上面那题的题目是:用小数计算下面各题
- 14急求CAD画三个已知半径,相切的圆弧怎么画,下图的R30,R10.
- 15中国古代绘画按内容可分为哪几种
