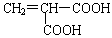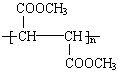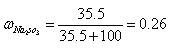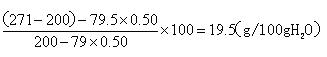防腐剂苯甲酸钠能不能用在洗发水上?
 Saul_hu2022-10-04 11:39:541条回答
Saul_hu2022-10-04 11:39:541条回答我现在搞不清楚洗发水.沐浴露.洗涤剂等日化产品,能不能用苯甲酸钠?苯甲酸钠是食用防腐还是日化防腐?请给个明确的说法~

已提交,审核后显示!提交回复
共1条回复
 黄脸婆1980 共回答了18个问题
黄脸婆1980 共回答了18个问题 |采纳率72.2%- 苯甲酸钠用于防腐应该可以用于日化产品的.
就是防止东西发霉变质呗.它们的机理都是一样的,就是不让细菌繁殖.
能用在食品中的防腐剂,都能用在日化产品上,都能吃,更别提用了.
但反过来就不行了. - 1年前
相关推荐
- 1、常用的防腐剂苯甲酸的化学式为C6H5COOH问:(1)苯甲酸由( )种元素组成,
1、常用的防腐剂苯甲酸的化学式为C6H5COOH问:(1)苯甲酸由( )种元素组成,
1个苯甲酸分子中含有( )个原子.(2)苯甲酸分子中C:H:O的原子个数比是( ),C:H:O的元素质量比是( ).(3)列式计算C6H5COOH的相对分子质量? 夏日烟愁1年前1
夏日烟愁1年前1 -
 wxs8069797 共回答了24个问题
wxs8069797 共回答了24个问题 |采纳率87.5%1个苯甲酸分子中含有( 15)个原子.(2)苯甲酸分子中C:H:O的原子个数比是( 7:6:2 ),C:H:O的元素质量比是( 42:3:16 ).(3)列式计算C6H5COOH的相对分子质量?
12*7+6*1+2*16=1221年前查看全部
- 造纸厂用的水处理药剂有哪些造纸厂用阻垢剂,缓蚀剂和防腐剂吗?
 孙来庆1年前2
孙来庆1年前2 -
 coffe777 共回答了15个问题
coffe777 共回答了15个问题 |采纳率86.7%工艺不一样,选用的药剂不一样.一般PAC,PAM在混凝反应中;还有FENTON中用到H2O2、FeSO4和NaOH;生化反应中用到尿素等等.1年前查看全部
- (2014•长葛市三模)藏硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,僵使用过量会使人中毒,国
(2014•长葛市三模)藏硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,僵使用过量会使人中毒,国酥上对食品中亚硝酸钠的用量控制在很低的本平上.某学习小组针对亚硝酸钠设计了如下实验:
【实验Ⅰ】制取NaNO2
该小组查阅资料知:2NO+Na2O2═2NaNO2;2NO2+Na2O2═2NaNO3设计割取装置如下(夹持装置略去):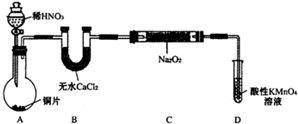
(1)装置D可将剩余的NO氧化成N03,发生反应的离子方程式为______.
(2)如果没有B装置,C中发生的副反应有______.
(3)甲同学梭在完气密往良好后进行实验,发现NaNO2的纯度较低.乙简学对上述装置进行了改进后提高了NaNO2的纯度,其改进措施是______.
(4)丙同学撩B中的药品进行了更换,也提高了NaNO2鲍纯度.丙更换的药最是______.
【实验Ⅱ】测定甲、乙同学制取样晶中NaNO2的含量
步骤:a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaN02呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10mL并振荡,制成标准色阶:
b.分别称量0.10g甲、乙制得的样品溶于水配成500mL溶液,贴上标签甲、乙.再分离别取5mL甲、乙待测液,各加入1mL M溶液,均加蒸馏水至10mL振荡,分别与标准色阶比较.试管编号 ① ② ③ ④ ⑤ NaNO2含量/mg•L-1 0 20 40 60 80
(5)步骤b中比较结果是:甲待测液颜色与③号色阶相同,乙待测液颜色与④号色阶相同.则甲同学制得的样品中NaN02的纯度是______%.
(6)用目视比色法证明维生素C可以有效降低NaNO2的含量.设计并完成下列实验报告.
实验方案 实验现象 实验结论 维生素C可以有效降低NaNO2的含量  csusoso1年前1
csusoso1年前1 -
 chbin1016 共回答了18个问题
chbin1016 共回答了18个问题 |采纳率83.3%(1)高锰酸钾具有氧化性,能将一氧化氮氧化,反应的实质是:5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O,故答案为:5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O;
(2)金属铜和稀硝酸制得的一氧化氮中含有水,水会和过氧化钠发生反应产生氧气,2Na2O2+2H2O=4NaOH+O2↑,生成的氧气极易把一氧化氮氧化为二氧化氮,即2NO+O2=NO2,故答案为:2Na2O2+2H2O=4NaOH+O2↑;2NO+O2=NO2;
(3)由于获得一氧化氮所用的硝酸具有挥发性,这样会干扰实验结果,可以在A、B之间增加装有水的洗气瓶,减小实验误差,故答案为:在A、B之间增加装有水的洗气瓶;
(4)由于获得NO的过程中伴随的杂质会对实验结果产生影响,这样采用的干燥剂和除杂试剂可以选择碱石灰或是氧化钙,故答案为:碱石灰或氧化钙;
(5)甲待测液颜色与③号色阶相同,则甲同学制得的样品中NaN02的纯度是
40×10−3g×100
0.1g×100%=40%,故答案为:40;
(6)要和(5)中的贾同学的实验方案形成对比试验,同样可以是先取5mL甲待测液,然后加入维生素C,并加入1 mLM溶液,最后加入蒸馏水至10mL,若紫红色比③色阶浅,说明亚硝酸钠的含量低,则可以证明维生素C可以有效降低NaNO2的含量.
故答案为:实验方案:取5mL甲待测液加入维生素C,振荡,再加入1 mL M溶液,加入蒸馏水至10mL;实验现象:紫红色比③色阶浅.1年前查看全部
- 我用AES+磺酸+片碱+6501+防腐剂+香精+二钠做出洗洁精为什么发黄还不透明请个高手回答一下 急用
我用AES+磺酸+片碱+6501+防腐剂+香精+二钠做出洗洁精为什么发黄还不透明请个高手回答一下 急用
按百公斤AES用了7公斤 磺酸用3公斤 6501 4公斤 盐用了2斤你看行吗 你有好的配方吗 二钠用了3两 xht6181年前1
xht6181年前1 -
 zhuxying 共回答了26个问题
zhuxying 共回答了26个问题 |采纳率88.5%AES过少,磺酸过多,重新调整比例就行,还有看盐比例是不是过量了.1年前查看全部
- 有机物 为食品包装纸的常用防腐剂。A可以使溴水褪色。A难溶于水,但在酸性条件下可发生水解反应,得到 和甲醇。通常状况下B
有机物 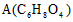 为食品包装纸的常用防腐剂。A可以使溴水褪色。A难溶于水,但在酸性条件下可发生水解反应,得到
为食品包装纸的常用防腐剂。A可以使溴水褪色。A难溶于水,但在酸性条件下可发生水解反应,得到 和甲醇。通常状况下B为无色晶体,能与氢氧化钠溶液发生反应。
和甲醇。通常状况下B为无色晶体,能与氢氧化钠溶液发生反应。
(1)A可以发生的反应有_________(选填序号)。
①加成反应 ②酯化反应 ③加聚反应 ④氧化反应
(2)B分子所含官能团的名称是____________。
(3)B分子中没有支链,其结构简式是_____________,B的具有相同官能团的同分异构体的结构简式是
______________。
(4)由B制取A的化学方程式是_______________。
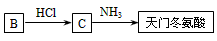
(5)天门冬氨酸是组成人体蛋白质的氨基酸之一,可由B通过以下反应制取: 天门冬氨酸的结构简式是
__________________。
 rookie5201年前1
rookie5201年前1 -
 SDY_LIU 共回答了12个问题
SDY_LIU 共回答了12个问题 |采纳率100%有机物 为食品包装纸的常用防腐剂。A可以使溴水褪色。A难溶于水,但在酸性条件下可发生水解反应,得到
为食品包装纸的常用防腐剂。A可以使溴水褪色。A难溶于水,但在酸性条件下可发生水解反应,得到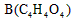 和甲醇。通常状况下B为无色晶体,能与氢氧化钠溶液发生反应。
和甲醇。通常状况下B为无色晶体,能与氢氧化钠溶液发生反应。
(1)A可以发生的反应有_________(选填序号)。
①加成反应 ②酯化反应 ③加聚反应 ④氧化反应
(2)B分子所含官能团的名称是____________。
(3)B分子中没有支链,其结构简式是_____________,B的具有相同官能团的同分异构体的结构简式是
______________。
(4)由B制取A的化学方程式是_______________。
(5)天门冬氨酸是组成人体蛋白质的氨基酸之一,可由B通过以下反应制取: 天门冬氨酸的结构简式是
__________________。
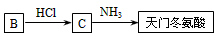
(1)①③④
(2)碳碳双键、羧基
(3)
(4)
(5)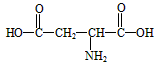 1年前查看全部
1年前查看全部
- (2013•重庆)亚硝酸钠(NaNO2)是一种工业用盐,虽然有毒但也可以用作防腐剂.NaNO2中氮元素的化合价是( )
(2013•重庆)亚硝酸钠(NaNO2)是一种工业用盐,虽然有毒但也可以用作防腐剂.NaNO2中氮元素的化合价是( )
A.+5
B.+3
C.+1
D.-3 okyesokyes1年前1
okyesokyes1年前1 -
 花儿想飞 共回答了12个问题
花儿想飞 共回答了12个问题 |采纳率75%解题思路:根据在化合物中正负化合价代数和为零,结合亚硝酸钠(NaNO2)的化学式进行解答本题.钠元素显+1价,氧元素显-2价,设氮元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)×2=0,则x=+3价.
故选B.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度不大,掌握利用化合价的原则计算指定元素的化合价的方法即可正确解答本题.1年前查看全部
- (2012•大兴区一模)食品保鲜的措施有添加防腐剂、充填气体、放置干燥剂和脱氧剂等.
(2012•大兴区一模)食品保鲜的措施有添加防腐剂、充填气体、放置干燥剂和脱氧剂等.
(1)丙酸钠是一种常用的防腐剂,其化学式为C3H5O2Na.它由______ 种元素组成,碳元素和氧元素的质量比为______.
(2)生石灰是常用的干燥剂.请用化学方程式表示其作干燥剂的原因______.
(3)铁粉也可用作保鲜剂,它利用了铁生锈的原理,所以又称“双吸剂”.这里的“双吸”是吸收空气中的______.有一袋铁粉使用了一段时间,表面已经生锈,经验证它还可以继续使用,其验证方法是加入过量的稀盐酸,写出有关反应的化学方
程式______、______. 空白20081年前1
空白20081年前1 -
 chyx23 共回答了17个问题
chyx23 共回答了17个问题 |采纳率76.5%解题思路:(1)根据丙酸钠化学式的含义、化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(2)生石灰能与水反应生成氢氧化钙,写出反应的化学方程式即可.
(3)根据铁生锈的条件进行分析,铁锈的成分是氧化铁,能与盐酸反应,铁能与盐酸反应生成氯化亚铁和氢气,据此写出反应的化学方程式即可.(1)由丙酸钠化学式可知,丙酸钠是由碳、氢、氧、钠四种元素组成的,碳元素和氧元素的质量比为(12×3):(16×2)=9:8.
(2)生石灰作干燥剂的原因是能与水反应生成氢氧化钙,反应的化学方程式为CaO+H2O=Ca(OH)2.
(3)铁易吸收空气中的氧气、水蒸气生成铁锈,铁锈的主要成分是氧化铁,能与盐酸反应生成氯化铁和水,反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O;铁能与过量的盐酸反应生成氯化亚铁和氢气,反应的化学方程式为:Fe+2HCl=FeCl2+H2↑.
故答案为:(1)4;9:8;(2)CaO+H2O=Ca(OH)2;(3)氧气、水蒸气;Fe2O3+6HCl=2FeCl3+3H2O;Fe+2HCl=FeCl2+H2↑.点评:
本题考点: 食品干燥剂、保鲜剂和真空包装的成分探究;金属锈蚀的条件及其防护;生石灰的性质与用途;酸的化学性质;元素质量比的计算;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,掌握化学式的含义、生石灰的化学性质、铁生锈的条件、酸的化学性质等是正确解答本题的关键.1年前查看全部
- 有机物X为食品包装纸的常用防腐剂。已知:
有机物X为食品包装纸的常用防腐剂。已知:
①X的相对分子质量小于150,其中氧的质量分数约为44.4%
②1molX在稀硫酸中发生水解反应生成2mol甲醇和1molY
③Y可使溴的四氯化碳溶液褪色
根据以上信息填写下列空白:
(1)1个X分子中,可能含有______________个氧原子
(2)X可以发生的反应有______________(填序号)
①加成反应 ②酯化反应 ③氧化反应 ④消去反应
(3)Y分子中没有支链,其结构简式是______________,
(4)写出Y的同分异构体的结构简式______________(任写一种)
(5)写出X在一定条件下发生加聚反应得到高分子化合物的结构简式:______________
(6)写出X在足量氢氧化钠溶液中反应的化学方程式:____________________________ woowinder1年前1
woowinder1年前1 -
 俊凌 共回答了16个问题
俊凌 共回答了16个问题 |采纳率93.8%1年前查看全部
- 人造奶油是以氢化的植物油、液体油和动物油为原料,按一定比例与乳化剂、色素、调味剂、强化剂、抗氧化剂、防腐剂等调和而成。
人造奶油是以氢化的植物油、液体油和动物油为原料,按一定比例与乳化剂、色素、调味剂、强化剂、抗氧化剂、防腐剂等调和而成。
(1)脂肪和油都属于酯类物质,它们的主要区别是脂肪常温下为________体,油常温下为________体;
(2)将植物油进行氢化时的反应类型是________(填序号);
(3)人造奶油在人体内经消化后的产物是甘油和脂肪酸,消化的实质从化学上看属于________反应。A.加成反应 B.取代反应 C.氧化反应 D.水解反应  eternal09071年前1
eternal09071年前1 -
 bd456 共回答了13个问题
bd456 共回答了13个问题 |采纳率100%(1)固 液 (2)A (3)水解(取代)
由于植物油的不饱和度高,熔点低,流动性强,不容易保存,所以可以使植物油和氢气发生加成反应,以减少不饱和度,使植物油硬化;油脂水解可以生成甘油和脂肪酸,所以人造奶油在人体内经消化的实质从化学上看属于水解(取代)反应。1年前查看全部
- CuCl和CuCl 2 都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
CuCl和CuCl 2 都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl 2 用适当的还原剂如SO 2 、SnCl 2 等还原制得: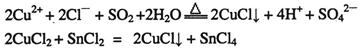
②CuCl 2 溶液与乙二胺(H 2 N-CH 2 -CH 2 -NH 2 )可形成配离子: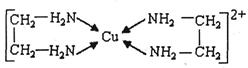
请回答下列问题:
(1)基态Cu原子的核外电子排布式为 ,H、N、O三种元素的电负性由大到小的顺序是 。
(2)SO 2 分子的空间构型为 ,与SnCl 4 互为等电子体的一种离子的化学式为 。
(3)乙二胺分子中氮原子轨道的杂化类型为 ,乙二胺和三甲胺[N(CH 3 ) 3 ]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 。
(4)②中所形成的配离子中含有的化学键类型有 。(填字母)
A 配位键 B 极性键 C 离子键 D 非极性键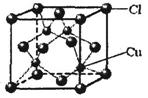
(5)CuCl的晶胞结构如上图所示,其中Cl原子的配位数为 。 大话三dd481年前1
大话三dd481年前1 -
 tianshizhiyu28 共回答了20个问题
tianshizhiyu28 共回答了20个问题 |采纳率85%(1)1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 或[Ar]3d 10 4s 1 (2分) O >N >H(1分)
(2)V形(1分) SO 4 2- 、SiO 4 4- 等(2分)
(3)sp 3 杂化(1分)乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键(1分)
(4)abd(2分)(5)4(2分)
略1年前查看全部
- (2010•延庆县二模)随着人们生活水平的提高,人们对于食品不但要求营养,更要求健康.市场上出现了一些不添加防腐剂的绿色
 (2010•延庆县二模)随着人们生活水平的提高,人们对于食品不但要求营养,更要求健康.市场上出现了一些不添加防腐剂的绿色食品,这种食品中有一个单独包装的保鲜剂,不会危害食品安全.某同学找来一种在空气中放置一段时间的食品保鲜剂,对它进行探究.
(2010•延庆县二模)随着人们生活水平的提高,人们对于食品不但要求营养,更要求健康.市场上出现了一些不添加防腐剂的绿色食品,这种食品中有一个单独包装的保鲜剂,不会危害食品安全.某同学找来一种在空气中放置一段时间的食品保鲜剂,对它进行探究.
【查找资料】
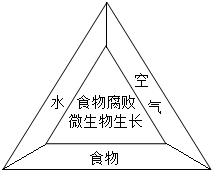
(1)食物腐败是因为微生物在食物上生长.如图所示,微生物只要得到养分,再加上充足的氧气和水,在适当的条件下就会迅速生长.因此,只要缺少一种条件,就可以防止食物腐败.
(2)常见的具有吸水性的物质有以下几种:
①浓硫酸②生石灰③氢氧化钠固体④铁粉
⑤硅胶(化学式SiO2•nH2O,无色透明粒状固体,无毒无害)
【活动与探究】
(3)初步探究:你认为①~⑤的物质中,不适合做食品干燥剂的是浓硫酸和氢氧化钠固体浓硫酸和氢氧化钠固体,理由是因为这两种物质均有强烈的腐蚀性因为这两种物质均有强烈的腐蚀性.
(4)实验探究:
【活动反思】实验 操作 主要现象 结论与解释 实验1
初步判断打开这种保鲜剂的包装袋,取少量样品于试管中,进行观察. 该样品为白色固体. 该保鲜剂一定不是铁粉和硅胶铁粉和硅胶. 实验2
对该保鲜剂的有效性进行探究向实验1的试管中加入适量的水,震荡. 形成白色浑浊液体,试管壁发热. 结论与相关反应方程式
该保鲜剂仍有效,CaO+H2O=Ca(OH)2该保鲜剂仍有效,CaO+H2O=Ca(OH)2.实验3
对该保鲜剂的成分进行探究过滤实验2所的液体,向滤液中通入二氧化碳. 溶液变浑浊. 该保鲜剂中一定含有的物质是
氧化钙和碳酸钙氧化钙和碳酸钙,对于实验3不能确定的物质是氢氧化钙氢氧化钙.将滤渣放入另一试管中,加入足量稀盐酸. 有气泡产生.
(5)对于实验3不能确定的物质,某同学经过仔细研究,认为直接取原固体滴加酚酞溶 液,通过观察颜色变化即可确定是否含有该物质,你认为这种方法是否合理?说明理由不合理,因为既使没有Ca(OH)2,CaO与酚酞溶液中含有的水发生反应也会生成Ca(OH)2而使酚酞变红不合理,因为既使没有Ca(OH)2,CaO与酚酞溶液中含有的水发生反应也会生成Ca(OH)2而使酚酞变红.
(6)请根据食物腐败的条件分析,我们除可以使用这些保鲜剂外,还可以采用的保鲜方法是抽真空(或在食品袋中充氮气、二氧化碳等)抽真空(或在食品袋中充氮气、二氧化碳等).(写出一种即可) 流星07551年前1
流星07551年前1 -
 qpnldiv 共回答了19个问题
qpnldiv 共回答了19个问题 |采纳率94.7%解题思路:浓硫酸和氢氧化钠固体具有强烈的腐蚀性;根据物质的物理性质可以判断具体的物质;氧化钙能和水反应生成氢氧化钙;根据食品变质的条件可以找出防止食品变质的方法.【活动与探究】
(3)初步探究:因为浓硫酸和氢氧化钠固体具有强烈的腐蚀性,不能用作食品干燥剂.故填:浓硫酸和氢氧化钠固体;因为这两种物质均有强烈的腐蚀性.
实验 操作 主要现象 结论与解释
实验1 该保鲜剂一定不是铁粉和硅胶.因为铁粉是黑色的,硅胶是无色的.故填:该保鲜剂一定不是铁粉和硅胶.
实验2 该物质溶于水放热,并且产生白色浑浊液体,说明该保鲜剂没有变质.故填:该保鲜剂仍有效,CaO+H2O=Ca(OH)2.
实验3 通过实验1、2、3的探究可知,该保鲜剂中一定含有氧化钙和碳酸钙,不能确定是否含有的物质是氢氧化钙.故填:氧化钙和碳酸钙;氢氧化钙【活动反思】
(5)因为既使没有Ca(OH)2,CaO与酚酞溶液中含有的水发生反应也会生成Ca(OH)2而使酚酞变红.故填:不合理,因为既使没有Ca(OH)2,CaO与酚酞溶液中含有的水发生反应也会生成Ca(OH)2而使酚酞变红.
(6)可以采用的保鲜方法有:抽真空(或在食品袋中充氮气、二氧化碳等).故填:抽真空(或在食品袋中充氮气、二氧化碳等).点评:
本题考点: 食品干燥剂、保鲜剂和真空包装的成分探究.
考点点评: 解答本题要掌握各种物质的性质和实验现象等方面的内容,只有这样才能对相关方面的问题做出正确的判断.1年前查看全部
- 食品保鲜剂可以有效地防止食品的腐败变质.食品保鲜的措施有添加防腐剂、充填保护气体、放置干燥剂和脱氧保鲜剂等.一次,小明在
食品保鲜剂可以有效地防止食品的腐败变质.食品保鲜的措施有添加防腐剂、充填保护气体、放置干燥剂和脱氧保鲜剂等.一次,小明在食用盒装月饼时,发现用于保鲜的小纸袋中盛放着一种灰黑色粉末,几天后,看到灰黑色粉末已经变成红棕色.请回答:
①小纸袋中盛放的可能是______(填序号);
A.氮气B.生石灰C.还原性铁粉D.无水硫酸铜.
②为什么这种物质能起到保鲜作用?______
③请你设计简单实验证明这袋粉末?______. needachance1年前1
needachance1年前1 -
 simondai1983 共回答了18个问题
simondai1983 共回答了18个问题 |采纳率88.9%解题思路:铁与氧气和水反应生成锈,消耗了氧气,阻止了食品与氧气的反应,达到了保鲜的目的.铁锈的颜色是红棕色.要验证粉末的成分,可以取用盐酸,观察有无气泡产生,据此解答.①A氮气不会变成固体;B生石灰吸水会变成白色的粉末;C铁能与水和氧气反应生成铁锈,铁锈是红棕色的粉末;D不能放在食品包装中,因为硫酸铜是重金属盐,有毒;故填:C;
②C中的铁粉能与水和氧气反应,除去食品包装中的氧气,达到保鲜的目的.故填:铁粉可以跟食品包装袋中的少量氧气、水蒸气等物质反应生成铁锈,除去了氧气,从而达到保鲜的目的;
(3)粉末已经变成了红棕色,说明一定含有氧化铁,关键是证明有无铁粉,因此可以取粉末加入试管中,然后加入足量的盐酸,观察有无气泡产生,若有气泡产生,则含有铁粉,若无气泡,则无铁粉,故填:取粉末加入试管中,加入足量的稀盐酸,有气泡产生,则是铁与氧化铁的混合物,若无气泡,则是氧化铁粉末.点评:
本题考点: 食品干燥剂、保鲜剂和真空包装的成分探究;金属锈蚀的条件及其防护.
考点点评: 本题考查了铁粉作为双吸剂的特点以及有关的化学反应和物质的鉴别,完成此题,可以依据已有的知识进行.1年前查看全部
- 洗洁精核心母料4.5公斤+全能乳化剂2公斤+水+盐+防腐剂10克+香精5克+少量水质清澈剂.
 优悠鱼1年前1
优悠鱼1年前1 -
 2953779 共回答了16个问题
2953779 共回答了16个问题 |采纳率87.5%推荐配方一:主要针对生产0.5元以上一斤的洗洁精配方
洗洁精核心母料+全能乳化剂+水+防腐剂+香精+盐=洗洁精
生产洗洁精实用配比(参考,比例可以自己调整)
1、生产0.5元一斤配方:每百斤用量:洗洁精核心母料4公斤+全能乳化剂1.5公斤+水+盐+防腐剂10克+香精5克.稠度能与瓶装相当.
2、生产0.6元一斤的配方:每百斤用量:洗洁精核心母料4.5公斤+全能乳化剂2公斤+水+盐+防腐剂10克+香精5克.稠度超过瓶装.
3、其他价位的配方比例自己计算,配方比例调整原则:先定盐、洗洁精核心母料、防腐剂、香精的成本,最后定全能乳化剂的用量.
推荐配方二:主要针对生产0.3元以下一斤的洗洁精配方
洗洁精浓缩膏+水+防腐剂+香精+盐=洗洁精
生产特别低价的洗洁精实用配比(参考,比例可以自己调整)
1、生产0.15元一斤配方:每百斤用量:洗洁精浓缩膏1.8公斤+水+盐+防腐剂10克+香精5克.稠度起堆.
2、生产0.2元一斤配方:每百斤用量:洗洁精浓缩膏2.4公斤+水+盐+防腐剂10克+香精5克.稠度起堆很好.
3、生产0.25元一斤配方:每百斤用量:洗洁精浓缩膏3公斤+水+盐+防腐剂10克+香精5克.稠度接近瓶装.
4、生产0.3元一斤配方:每百斤用量:洗洁精浓缩膏3.7公斤+水+盐+防腐剂10克+香精5克.稠度与瓶装差不多.
5、其他价位的配方比例自己计算,每百斤用量=水+洗洁精浓缩膏
推荐配方三:主要针对生产0.3元至0.5元一斤的洗洁精配方
洗洁精精华膏+水+防腐剂+香精+盐=洗洁精
生产洗洁精实用配比(参考,比例可以自己调整)
1、生产0.3元一斤配方:每百斤用量:洗洁精精华膏3.2公斤+水+盐+防腐剂10克+香精5克.稠度起堆很好.
2、生产0.4元一斤配方:每百斤用量:洗洁精精华膏4.3公斤+水+盐+防腐剂10克+香精5克.稠度接近瓶装.
3、生产0.5元一斤配方:每百斤用量:洗洁精精华膏5.4公斤+水+盐+防腐剂10克+香精5克.稠度与瓶装相当.
4、生产0.6元一斤的配方:每百斤用量:洗洁精精华膏6.5公斤+水+盐+防腐剂10克+香精5克.稠度超过瓶装.
5、其他价位的配方比例自己计算,配方比例调整原则:先定盐防腐剂、香精的成本,最后定洗洁精精华膏的用量.
6、每百斤用量=水+洗洁精精华膏
洗洁精核心母料、洗洁精浓缩膏、洗洁精精华膏的区别
1、 稠度:洗洁精浓缩膏最高,洗洁精核心母料次之,洗洁精精华膏再次之.
2、 发泡:洗洁精核心母料最高,洗洁精精华膏次之,洗洁精浓缩膏再次之.
3、 除油去污:洗洁精精华膏最高,洗洁精核心母料次之,洗洁精浓缩膏再次之.
4、 透明度:洗洁精核心母料、洗洁精浓缩膏、洗洁精精华膏都是一样,象矿泉水一样透明.1年前查看全部
- 为使食品在较长的时间内保持色、香、味和口感,人们常在食品或食品包装中加入化学防腐剂.请根据图回答:
为使食品在较长的时间内保持色、香、味和口感,人们常在食品或食品包装中加入化学防腐剂.请根据图回答:

(1)苯甲酸中C、H、O元素的原子个数比为 ,C、H元素的质量比为 ,相对分子质量为 。
(2) g苯甲酸中含有6.4g氧元素。 linxiaolin20081年前1
linxiaolin20081年前1 -
 jeff林 共回答了18个问题
jeff林 共回答了18个问题 |采纳率94.4%(1)7:6:2 84:6(或 14:1) 122
(2)24.4(2分)
:(1)根据苯甲酸的化学式C 6 H 5 COOH可知苯甲酸中C、H、O元素的原子个数比为 7:6:2;C、H元素的质量比为:(12×7):(1×6)=14:1;相对分子的质量为组成分子的各原子的质量之和,C 6 H 5 COOH的相对分子量为 12×7+1×6+16×2=122;
(2)设 x g苯甲酸中含有6.4g氧元素
6.4g=x×【(16×2)÷(12×7+6+16×2)】×100%
解答 x="24.4" g1年前查看全部
- 请用化学式或化学符号填空:高度白酒的主要成分是______;食盐常用调味品和防腐剂,其主要成分含有的微粒是______;
请用化学式或化学符号填空:高度白酒的主要成分是______;食盐常用调味品和防腐剂,其主要成分含有的微粒是______;焙制糕点所用发酵粉主要成分之一的盐是______.
 zl7712191年前1
zl7712191年前1 -
 笨小丫头 共回答了18个问题
笨小丫头 共回答了18个问题 |采纳率88.9%解题思路:首先根据题意确定物质的化学名称,然后根据题目所提供的元素、书写化学式或离子符号的方法和步骤写出物质的化学式或离子符号即可.高度白酒的主要成分是乙醇,其化学式为:C2H5OH.
食盐常用调味品和防腐剂,其主要成分氯化钠含有的微粒是钠离子和氯离子,其离子符号为:Na+、Cl-.
焙制糕点所用发酵粉主要成分之一的盐碳酸氢钠,其化学式为:NaHCO3.
故答案为:C2H5OH;Na+、Cl-;NaHCO3.点评:
本题考点: 化学式的书写及意义;化学符号及其周围数字的意义.
考点点评: 本题难度不大,熟练掌握常见物质的性质、用途、组成及化学式或离子符号的书写是正确解答此类题的关键所在.1年前查看全部
- 用作消毒剂的盐,做防腐剂的盐,用作面粉发酵的盐,做建筑材料的盐,治胃酸过多的盐,有毒性可做波尔多液农药的盐,可做“钡餐”
用作消毒剂的盐,做防腐剂的盐,用作面粉发酵的盐,做建筑材料的盐,治胃酸过多的盐,有毒性可做波尔多液农药的盐,可做“钡餐”的盐分别是什么
 ninja9111年前3
ninja9111年前3 -
 77lin 共回答了15个问题
77lin 共回答了15个问题 |采纳率93.3%用作消毒剂的盐,NaClO
做防腐剂的盐,苯甲酸钠
用作面粉发酵的盐,NaHCO3
做建筑材料的盐,NaNO2
治胃酸过多的盐,NaHCO3
有毒性可做波尔多液农药的盐,CuSO4
可做“钡餐”的盐 BaSO41年前查看全部
- (2014•顺德区二模)红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示.同学们对一包久置的“50
 (2014•顺德区二模)红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示.同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究.
(2014•顺德区二模)红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示.同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究.
【提出问题】:久置固体的成分是什么?
【查阅资料】:铁与氯化铁溶液在常温下发生反应生成氯化亚铁.
【作出猜想】:久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2、CaCO3.
久置固体中可能含有Ca(OH)2 的原因是:用化学方程式表示______.
【实验探究】:甲同学的方案(见下表).
【实验质疑】:实验操作 实验现象 实验结论 (1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红 固体中一定含有______
和氢氧化钙(2)另取少量固体放于试管中,滴加足量的______ 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液 固体中一定含有______,一定不含有Fe2O3 (3)将步骤(2)中产生的气体通入到澄清石灰水中
______固体中一定含有CaCO3
(1)乙同学认为甲同学的实验中的实验中不能得出一定含有Ca(OH)2的结论,理由是______;
(2)丙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是______. lovezhiyuan1年前1
lovezhiyuan1年前1 -
 不醒的距离 共回答了14个问题
不醒的距离 共回答了14个问题 |采纳率100%解题思路:【作出猜想】本题探究了防腐剂的成分,双吸剂中含有生石灰,氧化钙久置能与水反应生成氢氧化钙,根据书写方程式的原则书写方程式.
【实验探究】:固体溶解时放出大量热,因为生石灰溶于水生成熟石灰放出大量的热,由此可以判断固体中一定含有氧化钙;取少量固体放于试管中,滴加足量的稀盐酸,固体逐渐消失,有大量无色气体产生,得到浅绿色溶液,固体中一定含有铁;将生成的气体通入澄清石灰水,澄清石灰水变浑浊,说明固体中一定含有CaCO3.
【实验质疑】(1)氧化钙与水反应生成的氢氧化钙也能使无色酚酞变红,不能确定原固体中是否含有氢氧化钙;
(2)不一定不含Fe2O3理由是:氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色.【作出猜想】:氧化钙在空气中能与空气中的水反应生成氢氧化钙,化学方程式为CaO+H2O=Ca(OH)2
【实验探究】:甲同学的方案:
(1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液,固体溶解时试管外壁发烫,说明一定含有氧化钙,氧化钙溶于水放出大量的热,试管底部有不容物,溶液变红;
(2)另取少量固体放于试管中,滴加足量的稀盐酸,有大量无色气体产生,得到浅绿色溶液,固体中一定含有铁;
(3)将步骤(2)中产生的气体通入到澄清的石灰水中,石灰水变浑浊,说明固体中一定含有碳酸钙,碳酸钙与盐酸反应产生二氧化碳使石灰水变浑浊.
【实验质疑】(1)不一定含有氢氧化钙,因为氧化钙和水反应生成氢氧化钙,也能使酚酞试液变红;
(2)不一定不含Fe2O3,因为氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色.
故答案为:【作出猜想】CaO+H2O=Ca(OH)2
【实验探究】氧化钙;稀盐酸;铁;澄清的石灰水变浑浊;
【实验质疑】氧化钙与水反应会生成氢氧化钙,也能使无色酚酞变红,不能确定原固体中是否有氢氧化钙;
氧化铁与盐酸反应生成氯化铁,铁与氯化铁溶液在常温下发生反应也会生成氯化亚铁,使溶液显浅绿色点评:
本题考点: 实验探究物质的组成成分以及含量;金属锈蚀的条件及其防护;生石灰的性质与用途;碱的化学性质;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;关于对实验设计方案的评价,要在两个方面考虑,一是方案是否可行,能否达到实验目的;二是设计的方法进行比较,那种方法更简便.本考点主要出现在实验题中.1年前查看全部
- 化学与生活、生产密切相关.(1)食盐是常用的调味品和防腐剂,其主要成分的构成粒子是______ (填化学符号)
化学与生活、生产密切相关.
(1)食盐是常用的调味品和防腐剂,其主要成分的构成粒子是______ (填化学符号).
(2)铁制品表面涂油、刷漆或镀铬都能防止铁生锈,其原理是______
(3)干粉灭火器中干粉的主要成分碳酸氢钠,灭火时受热分解生成碳酸钠、水和一种能灭火的气体,该反应的化学方程式是2NaHCO3
Na2CO3+H2O+CO2↑△ .2NaHCO3.
Na2CO3+H2O+CO2↑△ . 一个天体1年前1
一个天体1年前1 -
 bg12726 共回答了28个问题
bg12726 共回答了28个问题 |采纳率92.9%解题思路:(1)根据金属、大多数固态非金属单质、稀有气体单质等由原子构成,有些物质是由分子构成的,如水、氢气等,有些物质是由离子构成的,如氯化钠,进行分析解答即可.
(2)铁与水、氧气充分接触时容易生锈,使铁制品与氧气和水隔绝可以防止生锈.
(3)碳酸氢钠受热分解生成碳酸钠、水和一种能灭火的气体(由质量守恒定律,反应前后元素种类不变,该气体是二氧化碳),写出反应的化学方程式即可.(1)氯化钠是由钠离子和氯离子构成的,其离子符号分别是Na+、Cl-.
(2)铁制品表面涂油、刷漆或镀铬都能防止铁生锈,这些方法都能够防止锈蚀的共同原理是覆盖保护层,隔绝氧气和水.
(3)碳酸氢钠受热分解生成碳酸钠、水和一种能灭火的气体(由质量守恒定律,反应前后元素种类不变,该气体是二氧化碳),反应的化学方程式为:2NaHCO3
△
.
Na2CO3+H2O+CO2↑.
故答案为:(1)Na+、Cl-;(2)覆盖保护层,隔绝空气和水;(3)2NaHCO3
△
.
Na2CO3+H2O+CO2↑.点评:
本题考点: 分子、原子、离子、元素与物质之间的关系;金属锈蚀的条件及其防护;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,掌握常见物质的粒子构成、防止锈蚀的原理与措施、化学方程式的书写等是正确解答本题的关键.1年前查看全部
- (2006•济宁)食品保鲜剂可以有效地防止食品的腐败变质.食品保鲜的措施有添加防腐剂、充填保护气体、放置干燥剂和脱氧保鲜
(2006•济宁)食品保鲜剂可以有效地防止食品的腐败变质.食品保鲜的措施有添加防腐剂、充填保护气体、放置干燥剂和脱氧保鲜剂等.一次,小明在食用盒装月饼时,发现用于保鲜的小纸袋中盛放着一种灰黑色粉末,几天后,看到灰黑色粉末已经变成红棕色.请回答:
①小纸袋中盛放的可能是______(填序号);
A、氮气;B、生石灰;C、还原性铁粉;D、无水硫酸铜
②为什么这种物质能起到保鲜作用?______. dragon_wang1年前1
dragon_wang1年前1 -
 skdmh 共回答了26个问题
skdmh 共回答了26个问题 |采纳率84.6%解题思路:铁与氧气和水反应生成锈,消耗了氧气,阻止了食品与氧气的反应,达到了保鲜的目的.铁锈的颜色是红棕色.①A氮气不会变成固体;B生石灰吸水会变成白色的粉末;D不能放在食品包装中,因为硫酸铜有毒;
②C中的铁粉能与水和氧气反应,除去食品包装中的氧气,达到保鲜的目的.
故答案为:①C;②铁粉可以跟食品包装袋中的少量氧气、水蒸气等物质反应生成铁锈,除去了氧气,从而达到保鲜的目的.点评:
本题考点: 常见金属的特性及其应用;食品干燥剂、保鲜剂和真空包装的成分探究.
考点点评: 铁粉能吸收水和氧气,所以在食品包装中经常装入,被称为双吸剂.食品会变质多数是因为氧气的存在,只要除去了氧气,一般就能保鲜.1年前查看全部
- 不含人工色素,香精,化学防腐剂的润唇膏哪个牌子好
 niewu10241年前1
niewu10241年前1 -
 7pdf479 共回答了17个问题
7pdf479 共回答了17个问题 |采纳率88.2%应该叫自己做的牌子,你干脆用一块猪皮,没事了用来擦擦嘴就可以了,最天然和营养的了.1年前查看全部
- 请问防腐剂的主要成分是什么?
 jxwebman1年前3
jxwebman1年前3 -
 格林迪洛 共回答了20个问题
格林迪洛 共回答了20个问题 |采纳率80%防腐剂是指天然或合成的化学成分
亚硝酸盐及二氧化硫是常用的防腐剂之一 具体的你可以看看防腐剂百度百科的解释!比较详细!希望是你要的答案!1年前查看全部
- 火腿肠里的猪肉,淀粉,盐.糖,山梨酸钾,红曲红,辛香料,亚硝酸钠是防腐剂的有什么,是添加剂的有什么
 我的天堂村1年前1
我的天堂村1年前1 -
 wzabss 共回答了14个问题
wzabss 共回答了14个问题 |采纳率85.7%亚硝酸纳是防腐剂(抗氧化,防止酸败),山梨酸甲(增加风味)、红曲红(增加色泽)、辛香料(风味)是添加剂,猪肉和淀粉是原料,盐和糖是配料.1年前查看全部
- (2010•江苏二模)CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
(2010•江苏二模)CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
已知:①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:2Cu2++2Cl-+SO2+2H2O
2CuCl↓+4H++SO42-△ .
2CuCl2+SnCl2═2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子: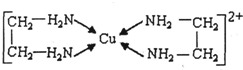
请回答下列问题:
(1)基态Cu原子的核外电子排布式为______,H、N、O三种元素的电负性由大到小的顺序是______.
(2)SO2分子的空间构型为______,与SnCl4互为等电子体的一种离子的化学式为______.
(3)乙二胺分子中氮原子轨道的杂化类型为______,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是______.
(4)②中所形成的配离子中含有的化学键类型有______.a.配位键b.极性键c.离子键d.非极性键
(5)CuCl的晶胞结构如下图所示,其中Cl原子的配位数为______.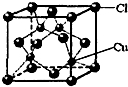
 FUJING1231年前1
FUJING1231年前1 -
 kakaloteo 共回答了15个问题
kakaloteo 共回答了15个问题 |采纳率100%解题思路:(1)根据铜的原子序数为29,结合能量最低原理书写基态原子的电子排布式,根据电负性的变化规律比较电负性大小;
(2)根据判断SO2分子含有的δ键以及孤电子对数判断空间构型,根据SnCl4含有的最外层电子数为50,以及含有5个原子判断等电子体;
(3)根据价层电子对数判断乙二胺分子中氮原子的杂化类型,根据是否含有氢键分析二者熔沸点高低不同的原因;
(4)根据成键原子的特点判断化学键类型;
(5)根据晶体结构特点分析Cl原子的配位数.(1)铜的原子序数为29,根据能量最低原理其态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,在元素周期表中同一周期从左到右元素的电负性逐渐增强,同一主族从上到下元素的电负性逐渐减弱,可知电负性强弱顺序为O>N>H,
故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;O>N>H;
(2)SO2分子中含有2个δ键,孤电子对数=[6−2×2/2]=1,所以分子为V形,SnCl4含有的价层电子数为50,并含有5个原子,与之为电子体的离子有SO42-、SiO44-等;
故答案为:V形;SO42-、SiO44-等;
(3)乙二胺分子中氮原子形成4个δ键,价层电子对数为4,氮原子为sp3杂化,乙二胺分子间可以形成氢键,物质的熔沸点较高,而三甲胺分子间不能形成氢键,熔沸点较低,
故答案为:sp3杂化;乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键;
(4)②中所形成的配离子中含有的化学键中N与Cu之间为配位键,C-C键为非极性键,C-N、N-H、C-H键为极性键,不含离子键,故答案为:abd;
(5)从CuCl的晶胞可以判断,每个铜原子与4个Cl距离最近且相等,即Cu的配位数为4,根据化学式可知Cl的配位数也为4,故答案为:4.点评:
本题考点: 晶胞的计算;原子核外电子排布;元素电离能、电负性的含义及应用;配合物的成键情况;“等电子原理”的应用;原子轨道杂化方式及杂化类型判断;氢键的存在对物质性质的影响.
考点点评: 本题考查较为综合,涉及电子排布式、分子的立体构型、杂化轨道类型、氢键、化学键类型以及晶体结构分析等知识,题目具有一定难度,本题注意晶胞配位数的判断方法,可根据CuCl的化学式进行比较.1年前查看全部
- 笨钾酸钠和山梨酸钾使用上的区别虽然两者都是防腐剂但不太清楚两者间的区别以及作用,我看很多食品和别的一些用品都会加入两者中
笨钾酸钠和山梨酸钾使用上的区别
虽然两者都是防腐剂但不太清楚两者间的区别以及作用,我看很多食品和别的一些用品都会加入两者中的一种但为什么呢两者的特性是什么谁能说明下谢谢 流泪风1年前1
流泪风1年前1 -
 如烟浩缪 共回答了19个问题
如烟浩缪 共回答了19个问题 |采纳率78.9%笨钾酸钠是一种防腐剂,多见于一些腌制品.如香肠,榨菜,豆腐干等.大量摄入对人有害.我们应该尽量少吃那些含笨钾酸钠高的食品
我们在选购包装(或罐装)食品时,配料一项中常常看到“山梨酸”或“山梨酸钾”的字样,人们往往会误认为可能是水果“梨”的成份.其实他们是常用的食品添加剂!不管他们对人体有没有危害,明明白白的消费确是非常必要的,以下是有关山梨酸、山梨酸钾的有关资料仅供参考:
山梨酸 (化学名称:2,4-己二烯酸 分子式:C6H8O2 〕
山梨酸钾 (化学名称:2,4-己二烯酸钾〕 分子式:C6H7KO2 )
山梨酸、山梨酸钾性能、用途相似:
【简介】山梨酸是国际粮农组织和卫生组织推荐的高效安全的防腐保鲜剂,广泛应用于食品、饮料、烟草、农药、化妆品等行业,作为不饱和酸,也可用于树脂、香料和橡胶工业.
【防腐性】
山梨酸(钾)能有效地抑制霉菌,酵母菌和好氧性细菌的活性,还能防止肉毒杆菌、葡萄球菌、沙门氏菌等
有害微生物的生长和繁殖,但对厌氧性芽孢菌与嗜酸乳杆菌等有益微生物几乎无效,其抑止发育的作用比杀菌作
用更强,从而达到有效地延长食品的保存时间,并保持原有食品的风味.
其防腐效果是同类产品苯甲酸钠的5-10倍.
【安全性】
由于山梨酸(钾)是一种不饱和脂肪酸(盐)它可以被人体的代谢系统吸收而迅速分解为二氧化碳和
水,在体内无残留.
ADI 0-25mg/kg (以山梨酸计,FAO/WHO 1994)
LD50 4920mg/kg (大鼠、经口)
GRAS (FDA,182.3640 1994)
其毒性仅为食盐的1/2,是苯甲酸钠的1/40
【稳定性】
山梨酸(钾)在密封状态下稳定,暴露在潮湿的空气中易吸水,氧化而变色.山梨酸钾对热稳定性较好,分
解温度高达270℃.
【使用范围】
目前已广泛地用于食品、饮料、酱菜、烟草、医药、化妆品、农产品、饲料等行业中,从发展趋势看,其应
用范围还在不断扩大.
山梨酸(钾)属酸性防腐剂,在接近中性(PH6.0-6.5)的食品中仍有较好的防腐作用,而苯甲酸(钠)的防腐
效果在PH>4时,效果已明显下降,且有不良味道.
【使用方式】
在使用时可以用直接添加,喷洒,浸渍,干粉喷雾,在包装材料上处理等多种方式.1年前查看全部
- 留取尿标本时常用的防腐剂的作用
 zhengmingshi1年前1
zhengmingshi1年前1 -
 karleuleralbert 共回答了23个问题
karleuleralbert 共回答了23个问题 |采纳率69.6%甲醛:固定尿中有机成分,防腐.常用于尿细胞记数.
浓盐酸:防止尿中激素被氧化,防腐.
甲苯:保持尿液的化学成分不变,防腐.常用于尿生化检验.1年前查看全部
- (6分)食品保鲜的措施有添加防腐剂、充填气体、放置干燥剂和脱氧剂等。
(6分)食品保鲜的措施有添加防腐剂、充填气体、放置干燥剂和脱氧剂等。
(1)丙酸钠是一种常用的防腐剂,其化学式为C 3 H 5 O 2 Na。它由 种元素组成,碳元素和氧元素的质量比为 。
(2)生石灰是常用的干燥剂。请用化学方程式表示其作干燥剂的原因 。
(3)铁粉也可用作保鲜剂,它利用了铁生锈的原理,所以又称“双吸剂”。这里的“双吸”是吸收空气中的 。有一袋铁粉使用了一段时间,表面已经生锈,经验证它还可以继续使用,其验证方法是加入过量的稀盐酸,写出有关反应的化学方程式 、 。 war269748811年前1
war269748811年前1 -
 猪啊你 共回答了13个问题
猪啊你 共回答了13个问题 |采纳率100%(1)4 9:8 (2)CaO + H 2 O=Ca(OH) 2 (3)氧气、水蒸气 Fe 2 O 3 + 6HCl=2FeCl 3 + 3H 2 O Fe + 2HCl=FeCl 2 + H 2 ↑ 1)由化学式...1年前查看全部
- 防腐剂中的灰黑色粉末和一些红色粉末是什么
 老实人吃亏1年前1
老实人吃亏1年前1 -
 mintbell 共回答了9个问题
mintbell 共回答了9个问题 |采纳率100%你指的是食品防腐剂吗?食品防腐剂通常都是白色的··变色了 可能是变质了··1年前查看全部
- 葡萄酒中的防腐剂焦亚硫酸钾和二氧化硫有什么区别?
葡萄酒中的防腐剂焦亚硫酸钾和二氧化硫有什么区别?
焦亚硫酸钾和二氧化硫有什么区别,我买的低端酒,便宜的基本都焦亚硫酸钾,中档或贵点的都是二氧化硫,是不是焦亚硫酸钾有问题啊?
偶然间发现这个问题. xx列车1年前1
xx列车1年前1 -
 孤舟横笛 共回答了13个问题
孤舟横笛 共回答了13个问题 |采纳率100%偏亚硫酸钾在化学上还有个别名,叫做偏亚硫酸钾,是欧美最常用的杀菌抗氧化辅料,其二氧化硫含量为57%.二氧化硫具有抗氧化、杀菌并促进有益微生物生长的作用,在葡萄酒的酿造过程中,二氧化硫已经成为保证葡萄酒质量不可取代的重要手段,在葡萄酒酿酒历史里已经有100多年,并被法律允许加进葡萄酒中.
欧盟规定,红葡萄的二氧化硫最高含量为160毫克/升(160ppm),白葡萄酒的二氧化硫最高含量为210毫克/升(210ppm).
其实这两个都是可以添加到葡萄酒中的,在适当的含量内对身体是没有任何影响的,你可以放心饮用.
很高兴能够回答你的问题.1年前查看全部
- 包装熟食制品中常加入防腐剂.丙酸钠是一种食品防腐剂,化学式为C3H5O2Na,丙酸钠中C、H、O、Na元素的质量比为__
包装熟食制品中常加入防腐剂.丙酸钠是一种食品防腐剂,化学式为C3H5O2Na,丙酸钠中C、H、O、Na元素的质量比为______,其相对分子质量为______.
 cocoollong1年前1
cocoollong1年前1 -
 蔷薇花飞 共回答了11个问题
蔷薇花飞 共回答了11个问题 |采纳率90.9%解题思路:根据丙酸钠化学式为C3H5O2Na,利用各元素的相对原子质量与分子中原子个数的乘积之比,计算丙酸钠中C、H、O、Na元素的质量比;利用相对分子质量为分子中各原子的相对原子质量总和,计算丙酸钠的相对分子质量.丙酸钠C3H5O2Na中C、H、O、Na元素的质量比=(12×3):(1×5):(16×2):23=36:5:32:23
丙酸钠C3H5O2Na的相对分子质量=12×3+1×5+16×2+23=96
故答案为:36:5:32:23;96.点评:
本题考点: 元素质量比的计算;相对分子质量的概念及其计算.
考点点评: 根据物质的化学式表示物质的组成和分子构成,利用物质的化学式可进行组成元素质量比、相对分子质量等与化学式有关的计算.1年前查看全部
- 尼泊金甲酯钠的水解已知防腐剂尼泊金甲酯不溶解水.尼泊金甲酯钠加水生成对羟甲基苯甲酸甲酯而有杀菌作用,而且水溶液呈碱性.以
尼泊金甲酯钠的水解
已知防腐剂尼泊金甲酯不溶解水.尼泊金甲酯钠加水生成对羟甲基苯甲酸甲酯而有杀菌作用,而且水溶液呈碱性.以下表述是否错误?是否可逆反应?请修正
①水解反应:NaO-C6H4-COOCH3 + H2O ==== HO-C6H4-COOCH3+ NaOH== NaO-C6H4-COOH + CH3OH.
有杀菌功能的HO-C6H4-COOCH3含量不多.
②加酸:反应同水解,由于酸中和NaOH,使反应朝生成 HO-C6H4-COOCH3进行,尼泊金甲酯积累较多,并有尼泊金甲酯沉淀析出.
③加碱:同水解反应,由于碱过量中和产物NaO-C6H4-COOH,反应完成彻底,生成NaO-C6H4-COONa.
④加无水乙醇:NaO-C6H4-COOCH3 +C2H5OH====NaO-C6H4-COOC2H5+CH3OH
谢 甜唯1年前2
甜唯1年前2 -
 苏影 共回答了19个问题
苏影 共回答了19个问题 |采纳率89.5%①水解反应NaO-C6H4-COOCH3 + H2O ==== HO-C6H4-COOCH3+ NaOH可逆
在室温下,酯的水解很慢,因此,只要是新配置的溶液,HO-C6H4-COOCH3含量还是很高的.
②正确
③正确,不过,由于酯的水解在室温下缓慢,要使NaO-C6H4-COOCH3的酯键水解需要放置相当长的时间.
④是一个酯交换反应,是可逆的,并且一般需要催化剂.1年前查看全部
- 铁为什么能吸水RT~或者说就是为什么能做防腐剂?
 维维么么1年前4
维维么么1年前4 -
 阳光竹林 共回答了19个问题
阳光竹林 共回答了19个问题 |采纳率78.9%铁被腐蚀生成的水合三氧化二铁(Fe2O3·nH2O)具有疏松的结构,因此能吸水,所以铁开始腐蚀很慢,但一旦表面生成铁锈继续生锈就特别快
楼上所说有误,铁生锈的过程是先生成Fe(OH)2,再被氧化为Fe(OH)3,氢氧化铁不稳定,在空气中的存在形式为Fe2O3·nH2O1年前查看全部
- 要详细配方,还有防腐剂哪里有卖啊?不好意思啊
 pansystar1年前1
pansystar1年前1 -
 东方枚子 共回答了20个问题
东方枚子 共回答了20个问题 |采纳率85%用于收藏的面塑通常用精面粉、糯米粉、盐、防腐剂及香油等制成,而用于食用的面塑则用澄粉、生粉等制成.1年前查看全部
- Na 2 SO 3 ·7H 2 O是食品工业中常用的漂白剂、抗氧化剂和防腐剂。Na 2 SO 3 在30℃时的溶解度为3
Na 2 SO 3 ·7H 2 O是食品工业中常用的漂白剂、抗氧化剂和防腐剂。Na 2 SO 3 在30℃时的溶解度为35.5g/100gH 2 O。
1)计算30℃时Na 2 SO 3 饱和溶液中Na 2 SO 3 的质量分数 。(保留2位小数)
。(保留2位小数)
[来源:学#科#网Z#X#X#K]
2)计算30℃时271g Na 2 SO 3 饱和溶液中水的质量。
3)将30℃的Na 2 SO 3 饱和溶液271g冷却到10℃,析出Na 2 SO 3 ·7H 2 O晶体79.5g。计算10℃时Na 2 SO 3 在水中的溶解度。 anwcwccc1年前1
anwcwccc1年前1 -
 wetfgewqukkeu 共回答了28个问题
wetfgewqukkeu 共回答了28个问题 |采纳率92.9%1年前查看全部
- 食品保鲜可以防止食品腐烂,保持食品的营养和味道.食品保鲜的措施有添加防腐剂、填充气体、放置干燥剂和脱氧保鲜剂等.市场上有
食品保鲜可以防止食品腐烂,保持食品的营养和味道.食品保鲜的措施有添加防腐剂、填充气体、放置干燥剂和脱氧保鲜剂等.市场上有一些充气包装的食品看上去像一个小“枕头”.袋内重的是什么气体呢?同学们有两种猜想:(A)氮气(B)氧气.请判断哪种猜想更合理并说明理由__________________________________
 AbJianhaobb1年前1
AbJianhaobb1年前1 -
 高善彪 共回答了22个问题
高善彪 共回答了22个问题 |采纳率95.5%氮气1年前查看全部
- 据《人民日报》报道,泡菜里有着色剂,果冻里有防腐剂,一支雪糕中含16种食品添加剂,一袋方便面里有14种…近九成的食品中含
据《人民日报》报道,泡菜里有着色剂,果冻里有防腐剂,一支雪糕中含16种食品添加剂,一袋方便面里有14种…近九成的食品中含有添加剂,下列关于添加剂的叙述正确的是( )
A. 现代的食品保存方法就是添加防腐剂
B. 食品添加剂越多越好
C. 添加的各种防腐剂,着色剂对人体无害
D. 我们一定要注意食品安全,不要盲目使用添加各种防腐剂的食品 平行追击1年前1
平行追击1年前1 -
 lanhuanyue 共回答了18个问题
lanhuanyue 共回答了18个问题 |采纳率83.3%解题思路:本题考查的是有食品安全的知识,重点是食品添加剂的问题,了解食品添加剂的相关知识,了解国家关于食品添加剂的相关规定.防腐剂是指保持食品原有的质量和食品营养价值为目的食品添加剂,它能抑制微生物的生长和繁殖,防止食品腐败变质而延长保质期,但大量的防腐剂对人体有一定的危害,因此我国防腐剂的使用有严格的规定,防腐剂符合以下标准才能使用:(1)合理使用对人体无害;(2)不影响消化道菌群;(3)在消化道内可降解为食物的正常成分;(4)不影响药物抗菌素的使用;(5)在对食品热处理时不产生有害成分.所以,虽然添加防腐剂是一种很好的防止食品腐败的方法,但不宜在食品中经常添加,应根据具体的情况来添加,添加防腐剂时必须有一定的剂量限制.
故选:D点评:
本题考点: 关注食品安全.
考点点评: “民以食为天,食以洁为本”,食品安全的考查多以选择题的形式出现,难度一般.1年前查看全部
- 食品添加剂对应正确的是A着色剂--甲酸钠B调味剂--亚硝酸钠C营养强化剂--赖氨酸D防腐剂--苋菜红
 可可39691年前1
可可39691年前1 -
 心儿的心 共回答了16个问题
心儿的心 共回答了16个问题 |采纳率100%选C
A、甲酸钠有剧毒,不可能用于食品添加剂.如果是苯甲酸钠,也不对.苯甲酸钠是防腐剂.不是着色剂
B、亚硝酸钠在肉制品中,起到着色、防腐作用,不是调味剂.
C、赖氨酸是人体必需氨基酸之一,是营养强化剂
D、苋菜红是红色的,用于着色剂.不是防腐剂1年前查看全部
- 怎么判断一个物质的官能团是什么有机物A(C6H8O4)为食品包装纸的常用防腐剂。A可以使溴水褪色,A难溶于水,但在酸性条
怎么判断一个物质的官能团是什么
有机物A(C6H8O4)为食品包装纸的常用防腐剂。A可以使溴水褪色,A难溶于水,但在酸性条件下可以发生水解反应,得到B(C4H4O4)和甲醇。通常状况下B为无色晶体,能与氢氧化钠溶液发生反应。
(1)A可以发生的反应有__________ (选填序号);
①加成反应
②酯化反应
③加聚反应
④氧化反应
(2)B分子所含官能团的名称是________、_______ ;
(3)B分子中没有支链,其结构简式是_______,B的具有相同官能团的同分异构体的结构简式是_______; (4)写出由B制取A的化学方程式:_________; bnm19871年前3
bnm19871年前3 -
 上坡起步 共回答了20个问题
上坡起步 共回答了20个问题 |采纳率85%只能靠自己去记了,如果想快点记住,最好和老师探讨一下,这个方法真的不错.
常见官能、醇、 醛 羧基 硝基 氨基 酮基 等
-OH、-CHO、-COOH、-NO2、--NH2、 RCO-,
有机化学反应主要发生在官能团上,官能团对有机物的性质起决定作用1年前查看全部
- 苯甲酸和苯甲酸及其盐类是什么区别,及其盐类是单独一种防腐剂的名称还是苯甲酸及其盐类是一种防腐剂名称啊!没有悬赏可以给了啊
 老qq1年前1
老qq1年前1 -
 lanshy 共回答了23个问题
lanshy 共回答了23个问题 |采纳率87%苯甲酸及其盐类就是苯甲酸和它的盐类(苯甲酸盐),“及”就是“和”的意思,防腐剂都是混合物,你说那种应该是由苯甲酸及其盐类共同构成.1年前查看全部
- Na2SO3•7H2O是食品工业中常用的漂白剂、抗氧化剂和防腐剂.Na2SO3在30℃时的溶解度为35.5g/100gH
Na2SO3•7H2O是食品工业中常用的漂白剂、抗氧化剂和防腐剂.Na2SO3在30℃时的溶解度为35.5g/100gH2O.
1)计算30℃时Na2SO3饱和溶液中Na2SO3的质量分数ω.(保留2位小数)
2)计算30℃时271g Na2SO3饱和溶液中水的质量.
3)将30℃的Na2SO3饱和溶液271g冷却到10℃,析出Na2SO3•7H2O晶体79.5g.计算10℃时Na2SO3在水中的溶解度. yingyin_star1年前1
yingyin_star1年前1 -
 lixiurong 共回答了15个问题
lixiurong 共回答了15个问题 |采纳率86.7%解题思路:1)根据溶质的质量分数=[溶质的质量/溶液的质量]和Na2SO3在30℃时的溶解度来计算饱和溶液中Na2SO3的质量分数ω;
2)根据Na2SO3在30℃时的溶解度来计算271g Na2SO3饱和溶液中水的质量;
3)根据Na2SO3•7H2O晶体和原溶液中溶质的质量求出10℃是饱和溶液中溶质的质量和溶剂的质量,再求出10℃时Na2SO3在水中的溶解度,即100g水中溶解 Na2SO3的质量.1)根据Na2SO3的溶解度,其饱和溶液中溶质为35.5g,溶剂为100g,溶液总质量=100+35.5=135.5g,
则ω(Na2SO3)=[35.5g/135.5g]≈0.26;
2)271g饱和溶液中,假设其含有的溶剂为x,
Na2SO3在30℃时的溶解度为35.5g/100gH2O,
则[100g/135.5g=
x
271g],
解之得:x=200(g);
3)冷却溶液后,析出晶体79.5g,根据其晶体Na2SO3•7H2O的组成,其中含有水和亚硫酸钠为:
m(Na2SO3)=79.5g×[126/126+126]=39.75g
m(H2O)=79.5g-39.75g=39.75g
10℃时Na2SO3的质量为271-200-39.75=31.25g
10℃时H2O的质量为200-39.75=160.25g
假设10℃时Na2SO3的溶解度为y
[100g/y=
160.25g
31.25g],
解得y=19.5g;
答:1)30℃时Na2SO3饱和溶液中Na2SO3的质量分数为0.26;
2)30℃时271g Na2SO3饱和溶液中水的质量为200g;
3)10℃时Na2SO3在水中的溶解度为19.5g.点评:
本题考点: 溶液中溶质的质量分数及相关计算;溶解度、饱和溶液的概念.
考点点评: 此题考查了溶液的质量分数、溶剂的质量、溶解度等化学计算知识,要理解溶解度的概念.1年前查看全部
- 氮气可以做防腐剂吗
 zjc12151年前1
zjc12151年前1 -
 sss_lzd 共回答了26个问题
sss_lzd 共回答了26个问题 |采纳率92.3%可以,当做防氧化气,比如膨化食品里的气体就是氮气.
在博物馆里,常将一些贵重而稀有的画页、书卷保存在充满氮气的圆筒里,这样就能使蛀虫在氮气中被闷死.利用氮气使粮食处于休眠和缺氧状态、代谢缓慢,可取得良好的防虫、防霉和防变质效果,粮食不受污染,管理比较简单,所需费用也不高,故近年来进展较快.近年来.我国不少地区也应用氮气来保存粮食,叫做“真空充氮贮粮”,亦可用来保存水果等农副产品.1年前查看全部
- 我国某著名榨菜具有低盐低糖、无防腐剂等特色,是中国名牌产品,远销美国、日本、加拿大等30多个国家。市场上常见的包装上标有
我国某著名榨菜具有低盐低糖、无防腐剂等特色,是中国名牌产品,远销美国、日本、加拿大等30多个国家。市场上常见的包装上标有“质量80g”字样,则1包榨菜的重力是多少?(g=10N/kg)  鲸鲨吹水1年前0
鲸鲨吹水1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 包装的食品时,常加防腐剂苯甲酸钠它的相对分子质量是多少?
 斯哥1年前1
斯哥1年前1 -
 11011000 共回答了26个问题
11011000 共回答了26个问题 |采纳率88.5%1441年前查看全部
- 不能在A级绿色食品中出现的防腐剂是( )A、山梨酸 B、苯甲酸 C、丙酸
 zgh673991年前2
zgh673991年前2 -
 jujingy 共回答了17个问题
jujingy 共回答了17个问题 |采纳率94.1%B、苯甲酸1年前查看全部
- (2012•鞍山一模)防腐剂山梨酸钾的化学式为C6H7KO2,试回答:
(2012•鞍山一模)防腐剂山梨酸钾的化学式为C6H7KO2,试回答:
(1)山梨酸钾由______种元素组成.
(2)山梨酸钾的相对分子质量为______.
(3)山梨酸钾中钾元素的质量分数为______. 南加巴瓦1年前1
南加巴瓦1年前1 -
 诺亚1980 共回答了27个问题
诺亚1980 共回答了27个问题 |采纳率81.5%解题思路:(1)化学式进行分析其元素组成;
(2)根据相对分子的质量为组成分子的各原子的相对原子质量之和,进行解答;
(3)根据化合物中某元素质量分数=[该原子的相对原子质量×原子个数/相对分子质量]×100%,进行解答.(1)根据化学式C6H7KO2进行分析,是由C、H、K、O四种元素组成;
(2)根据相对分子的质量为组成分子的各原子的相对原子质量之和,可得山梨酸钾的相对分子质量
为:12×6+1×7+39+16×2=150;故答案为:150;
(3)根据化合物钾某元素质量分数=[该原子的相对原子质量×原子个数/相对分子质量]×100%=[39×1/150]×100%=26%..
故答案为:(1)四(2)150(3)26%点评:
本题考点: 物质的元素组成;相对分子质量的概念及其计算;元素的质量分数计算.
考点点评: 本题考查学生对物质化学式含义的理解及根据化学式分析其组成及相对分子质量、元素质量分数的解题的能力.1年前查看全部
- 亚硝酸钠到底属于什么分类?为什么不是防腐剂或则调味剂?请根据化学与生活里面内容回答?
 yaya芷宁1年前1
yaya芷宁1年前1 -
 tongrentang 共回答了25个问题
tongrentang 共回答了25个问题 |采纳率96%分类没有特定的界限,它既属盐也属还原剂,还属氧化剂(相对还原性更强的物质来说),也是盐,也是防腐剂!调味剂:改善食品的感官性质,使食品更加美味可口,并能促进消化液的分泌和增进食欲的对人体无害的食品添加剂.调味剂的种类很多,主要包括咸味剂(主要是食盐)、甜味剂(主要是糖、糖精等)、鲜味剂、酸味剂等.亚硝酸盐具有致癌作用,在调味剂定义上并不符合对人体无害这一条件!防腐剂是指天然或合成的化学成分,用于加入食品、药品、颜料、生物标本等,以延迟微生物生长或化学变化引起的腐败.亚硝酸盐及二氧化硫是常用的防腐剂之一.1年前查看全部
- (2012•西城区二模)红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示.同学们对一包久置的“50
(2012•西城区二模)红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示.同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究.
提出问题:久置固体的成分是什么?品名:504双吸剂
成分:铁粉、生石灰等
查阅资料:铁与氯化铁溶液在常温下发生反应生成氯化亚铁.
作出猜想:久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3.
实验探究:
甲同学的方案:
乙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是______.并设计如下实验方案继续验证.实验操作 实验现象 实验结论 取少量固体放于试管中,滴加足量的______. 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液. 固体中一定含有______,
一定不含Fe2O3.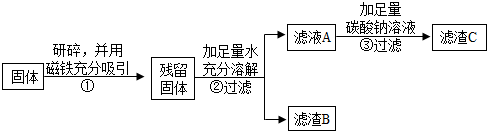
(1)②中固体溶解时放出大量热,由此可以判断固体中一定含有______.
(2)③中反应的化学方程式是______.
乙同学对滤渣B又进行探究.
丙同学认为乙同学的方案中仍有一种物质不能确定.丙同学经过实验测得上述残留固体中含钙物质的总质量为1.6g,滤渣B中CaCO3的质量为1.0g,滤渣C的质量为1.0g.实验操作 实验现象 实验结论 ______ ______ 固体中一定含有CaCO3
和Fe2O3.
综合上述实验及所给数据,久置固体的成分是______. 严重棵1年前1
严重棵1年前1 -
 yangyangjz 共回答了15个问题
yangyangjz 共回答了15个问题 |采纳率80%解题思路:本题探究了防腐剂的成分,取少量固体放于试管中,滴加足量的稀盐酸,固体逐渐消失,有大量无色气体产生,得到浅绿色溶液,固体中一定含有铁,不一定不含Fe2O3理由是:氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色.由乙同学的设计方案可知:磁铁吸引了铁粉,②中固体溶解时放出大量热,因为生石灰溶于水生成熟石灰放出大量的热,由此可以判断固体中一定含有氧化钙;滤液A中的氢氧化钙和碳酸钠反应生成碳酸钙白色沉淀和氢氧化钠,配平即可;对滤渣B又进行探究:①取滤渣B于试管中,加入适量稀盐酸,固体减少,有气泡冒出,溶液变为黄色;②将生成的气体通入澄清石灰水,澄清石灰水变浑浊;固体中一定含有CaCO3和Fe2O3.丙同学认为乙同学的方案中仍有一种物质氢氧化钙不能确定,因此经过实验测得上述残留固体中含钙物质的总质量为1.6g,而滤渣B中CaCO3的质量为1.0g,滤渣C的质量为1.0g,即钙元素质量是:2.0g×
×100%=0.8g,1.6g>0.8g,因此一定有氢氧化钙,即久置固体的成分是:Fe、Fe2O3、CaO、Ca(OH)2、CaCO3.40 100 甲同学的方案:取少量固体放于试管中,滴加足量的稀盐酸,固体逐渐消失,有大量无色气体产生,得到浅绿色溶液,固体中一定含有铁,故答案为:稀盐酸Fe
乙同学:不一定不含Fe2O3理由是:氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色.故答案为:理由:氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色.
(1)由乙同学的设计方案可知:磁铁吸引了铁粉,②中固体溶解时放出大量热,因为生石灰溶于水生成熟石灰放出大量的热,由此可以判断固体中一定含有氧化钙;故答案为:CaO
(2)滤液A中的氢氧化钙和碳酸钠反应生成碳酸钙白色沉淀和氢氧化钠,配平即可;故答案为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
对滤渣B的探究:①取滤渣B于试管中,加入适量稀盐酸,固体减少,有气泡冒出,溶液变为黄色;②将生成的气体通入澄清石灰水,澄清石灰水变浑浊;固体中一定含有CaCO3和Fe2O3.故答案为:
实验操作实验现象实验结论
①取滤渣B于试管中,加入适量稀盐酸.
②将生成的气体通入澄清石灰水.①固体减少,有气泡冒出,溶液变为黄色.
②澄清石灰水变浑浊.【实验结论】丙同学认为乙同学的方案中仍有一种物质氢氧化钙不能确定,因此经过实验测得上述残留固体中含钙物质的总质量为1.6g,而滤渣B中CaCO3的质量为1.0g,滤渣C的质量为1.0g,即钙元素质量是:2.0g×
40
100×100%=0.8g,1.6g>0.8g,因此一定有氢氧化钙,即久置固体的成分是:Fe、Fe2O3、CaO、Ca(OH)2、CaCO3.故答案为:Fe、Fe2O3、CaO、Ca(OH)2、CaCO3点评:
本题考点: 实验探究物质的组成成分以及含量;常见金属的特性及其应用;酸的化学性质;盐的化学性质.
考点点评: 有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;关于对实验设计方案的评价,要在两个方面考虑,一是方案是否可行,能否达到实验目的;二是设计的方法进行比较,那种方法更简便.本考点主要出现在实验题中.1年前查看全部
- 丁子香酚可用于配制康乃馨型香精及制作杀虫剂和防腐剂,结构简式如图所示.下列物质在一定条件下不能跟丁子香酚反应的是( )
 丁子香酚可用于配制康乃馨型香精及制作杀虫剂和防腐剂,结构简式如图所示.下列物质在一定条件下不能跟丁子香酚反应的是( )
丁子香酚可用于配制康乃馨型香精及制作杀虫剂和防腐剂,结构简式如图所示.下列物质在一定条件下不能跟丁子香酚反应的是( )
A.NaOH溶液
B.Na2CO3溶液
C.FeCl3溶液
D.新制Cu(OH)2悬浊液 tylzhm1年前1
tylzhm1年前1 -
 wyc1999 共回答了18个问题
wyc1999 共回答了18个问题 |采纳率94.4%解题思路:分子中含有含有酚羟基,决定具有酚的性质,含有碳碳双键,决定具有烯的性质,含有醚键,具有醚的性质,含有苯环(苯环不是官能团),具有苯环性质.A、丁子香酚中存在的酚羟基,具有弱酸酸性,可与NaOH溶液,故A正确;
B、丁子香酚中存在的酚羟基,具有酸性,与Na2CO3溶液反应,生成碳酸氢钠,故B正确;
C、丁子香酚中存在的酚羟基,决定具有酚的性质,能与FeCl3溶液发生显色反应,故C正确;
D、酸性很弱,不能溶解新制Cu(OH)2悬浊液反应,无醛基不能与新制Cu(OH)2悬浊液反应,故D错误.
故选D.点评:
本题考点: 有机物分子中的官能团及其结构.
考点点评: 本题以物质的结构为载体,考查官能团及其性质,难度不大,关键认识官能团的结构,清楚官能团具有的性质.注意基础知识的掌握.1年前查看全部
- 丁子香酚可用于制作杀虫剂和防腐剂,其结构简式如图所示.
 丁子香酚可用于制作杀虫剂和防腐剂,其结构简式如图所示.
丁子香酚可用于制作杀虫剂和防腐剂,其结构简式如图所示.
(1)丁子香酚的分子式为______;不含氧的官能团的名称为______.
(2)下列物质在一定条件下能跟丁子香酚反应的是______(填序号).
①NaOH溶液②NaHCO3溶液 ③FeCl3溶液④Br2的CCl4溶液
(3)同时符合下述条件的丁子香酚的同分异构体共有______种,写出其中任意两种的结构简式______.
①能与NaHCO3溶液反应②苯环上只有两个取代基 ③苯环上的一氯取代物只有两种. 柔软的蝴蝶1年前1
柔软的蝴蝶1年前1 -
 畅菲 共回答了17个问题
畅菲 共回答了17个问题 |采纳率94.1%解题思路:(1)由结构简式可知分子式,分子中含酚-OH、醚键、碳碳双键;
(2)结合酚、烯烃的性质分析反应;
(3)符合下述条件的丁子香酚的同分异构体①能与NaHCO3溶液反应,含-COOH,②苯环上只有两个取代基,③苯环上的一氯取代物只有两种,则2个取代基在对位,以此来解答.(1)由结构简式可知分子式为C10H12O2,不含氧的官能团的名称为碳碳双键,故答案为:C10H12O2;碳碳双键;
(2)含酚-OH,可与NaOH、氯化铁反应,含碳碳双键与Br2的CCl4溶液反应,因苯酚的酸性比碳酸弱,则不能与碳酸氢钠反应,故答案为:②;
与NaHCO3溶液反应,可分子中应含有-COOH,苯环上的一氯取代物只有两种,说明两个取代基应位于对位位置,则对应的同分异构体有 ,
,
故答案为:5; 中的任意2种;
中的任意2种;点评:
本题考点: 有机物的结构和性质.
考点点评: 本题考查有机物的结构与性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的结构特点和官能团的性质,(3)为解答的难点,题目难度不大.1年前查看全部
大家在问
- 1(2012•安徽模拟)设椭圆C:x2a2+y2=1(a>0)的两个焦点是F1(-c,0)和F2(c,0)(c>0),且椭
- 2What is the short of "block"?
- 3This is your brother.中文是什么
- 4已知f(x)=x+(3/x)(1)判断并证明它的奇偶性.(2)证明f(x)在(负无穷,-根号3)上为增函数.
- 5求与双曲线x^2/16 -y^2/4=1有共同的焦点.且过点(3根号2,2)的双曲线方程
- 6郭鸣上是一个怎样的人.不要翻译.
- 7物理核聚变中关于公式和单位ΔE=Δmc 2 =0.0035uc 2 =0.0035×931.5MeV=3.26MeV .
- 8苍蝇飞进花园里的歇后语是什么
- 9妈妈,我爱你(1) 作文
- 10用适当的词语填空( )的双眼 ( )的痕迹 ( )的神色 ( )的拼搏( )的眼光 ( )的睡眼 ( )的烤鹅 ( )的
- 114x的二次方y-3x的二次方y+4xy的二次方是多少?
- 1212345678这8个数字能组成几组7个数字的,和6个数字
- 13蒸汽锅炉 蒸汽容量0.08T/H 最高压力1.5 最高温度151° 能否配1.5吨容量的化工反应釜,请回答
- 14已知下列反应均为放热反应,其中反应热最小的是 A.2A ( l ) + B (l ) =" 2C" (g )△H1 B.
- 15百般红紫斗芳菲的前半句是?