请加粗盐提纯出去杂质(Mg,Ca,SO4)的方程式写一下.告诉我为什么要先加BaCL2 以下是自己的理解 请指错
 wangba22022-10-04 11:39:542条回答
wangba22022-10-04 11:39:542条回答带有so4的溶液+BaCL2生成BaSO4沉淀,剩有过量的BaCL2
带有Mg的溶液+NaOH生成Mg(OH)2沉淀,盛有过量的NaOH
带有Ca的溶液+NaCO3生成沉淀CaCO3,剩有过量的NaCO3
然后用HCL出去杂质我就不会了
请高手帮我下以下除杂的方程式

已提交,审核后显示!提交回复
共2条回复
 凌乱不堪278 共回答了15个问题
凌乱不堪278 共回答了15个问题 |采纳率93.3%- 先加BaCl2是相对的,正确说法是BaCl2要加在Na2CO3前面,因为过量的Ba2+要用Na2CO3除去.
用HCl是为了出除去过量的NaOH和Na2CO3
除杂离子方程式:
SO4^2- + Ba2+ == BaSO4↓
Mg2+ + 2OH- == Mg(OH)2↓
Ca2+ + CO3^2- == CaCO3↓
Ba2+ + CO3^2- == BaCO3↓
过滤,加盐酸
H+ + OH- == H2O
2H+ + CO3^2- == H2O + CO2↑ - 1年前
 11000转 共回答了9个问题
11000转 共回答了9个问题 |采纳率- 必须要先加BaCl2是因为Ba离子也要除去,不然会引入新的杂质,要在CaCO3之前加入,这样BaCO3就沉淀出去了。
用盐酸除完杂质后加热就挥发了,就能得到产品。
除杂离子的方程式:
SO4^2- + Ba2+ = BaSO4↓
Mg2+ + 2OH- =Mg(OH)2↓
Ca2+ + CO3^2- =CaCO3↓
Ba2+ + CO3^2- =Ba... - 1年前
相关推荐
- 在粗盐的提纯实验中,几次用到了玻璃棒,起作用和目的是什么
 绝对帅5201年前1
绝对帅5201年前1 -
 wangjw0612 共回答了11个问题
wangjw0612 共回答了11个问题 |采纳率90.9%1.用托盘天平称取5克粗盐(精确到0.1克).用量筒量取10毫升水倒入烧杯里.用药匙取一匙粗盐加入水中,观察发生的现象.用玻璃棒搅拌,并观察发生的现象.接着再加入粗盐,边加边用玻璃棒搅拌,一直加到粗盐不再溶解时为止.观察溶液是否浑浊.在天平上称量剩下的粗盐,计算在10毫升水中大约溶解了多少克粗盐.x0d2.过滤:按照化学实验基本操作6所述方法进行过滤.仔细观察滤纸上的剩余物及滤液的颜色.滤液仍浑浊时,应该再过滤一次.如果经两次过滤滤液仍浑浊,则应检查实验装置并分析原因,例如,滤纸破损,过滤时漏斗里的液面高于滤纸边缘,仪器不干净等.找出原因后,要重新操作.x0d3.蒸发:把得到的澄清滤液倒入蒸发皿.把蒸发皿放在铁架台的铁圈上,用酒精灯加热(图20).同时用玻璃棒不断搅拌滤液.等到蒸发皿中出现较多量固体时,停止加热.利用蒸发皿的余热使滤液蒸干.x0d4.用玻璃棒把固体转移到纸上,称量后,回收到教师指定的容器.比较提纯前后食盐的状态并计算精盐的产率.玻璃棒:1、玻璃棒的搅拌2、引流3、搅拌4、转移固体1年前查看全部
- 稀盐酸怎么氧化亚硫酸跟 我老师将粗盐提纯的时候要先加入稀盐酸酸化 搞不大懂...
 托福考试1年前1
托福考试1年前1 -
 冰点0214 共回答了11个问题
冰点0214 共回答了11个问题 |采纳率100%不是氧化,是复分解反应:SO32- + 2 H+ = SO2 ↑+ H2O
化学方程式 Na2SO3 + 2 HCl = 2 NaCl + SO2↑ + H2O
可以除去SO32-1年前查看全部
- 高一粗盐的提纯实验设计方案 要求是表格形式 步骤、现象、结论、化学方程式.
高一粗盐的提纯实验设计方案 要求是表格形式 步骤、现象、结论、化学方程式.
表格形式
表格内容有步骤、现象、结论、化学方程式 蓝色小夭1年前1
蓝色小夭1年前1 -
 cuixp 共回答了16个问题
cuixp 共回答了16个问题 |采纳率75%操作步骤1溶称取约4克粗盐加入12毫升水中,并有玻璃棒搅拌
目的:使NaCl,MgCl2,CaCl2,Na2SO4,等溶于水.
2过滤:将粗盐水沿玻璃棒倒入过滤器中.
目的:除去粗盐中的不溶性杂质.
3蒸发:把得到的澄清滤液倒入蒸发皿中,把蒸发皿放在铁架台的铁圈上,用酒精灯加热,同时用玻璃棒不断搅拌滤液.
目的:从溶液中得到固体食盐.
粗盐提纯
一、实验步骤:溶解、过滤、蒸发
二、玻璃棒的作用:
(1)溶解时搅拌,加快溶解.
(2)过滤时,引流.
(3)蒸发时,搅拌使受热均匀.
三、过滤中的注意要点:一贴、二低、三靠
四、蒸发中的注意要点:玻璃棒搅拌,余热蒸干滤液.
取粗盐少量放入烧杯中,加适量水,用玻璃棒搅拌,待粗盐充分溶解后,把浑浊的食盐水沿玻璃棒倒入已安装好的过滤器中,再将得到的滤液在蒸发皿中加热,一直到滤液出现多量固体,停止加热.1年前查看全部
- 纯净的氯化钠是不潮解的,但粗盐很容易潮解,这主要是因为其中含有杂质MgCl2的缘故.为得到纯净的氯化钠,有人设计了一个实
纯净的氯化钠是不潮解的,但粗盐很容易潮解,这主要是因为其中含有杂质MgCl2的缘故.为得到纯净的氯化钠,有人设计了一个实验:把买来的粗盐放入纯氯化钠饱和溶液一段时间,过滤,洗涤,可得纯净的氯化钠晶体.则下列说法中,正确的是( )
A. 粗盐的晶粒大一些有利于提纯
B. 设计实验的根据是MgCl2比NaCl易溶于水
C. 在整个过程中NaCl饱和溶液浓度会变大(温度不变)
D. 设计实验的根据是NaCl的溶解平衡 kctvaba1年前2
kctvaba1年前2 -
 needfeeling 共回答了13个问题
needfeeling 共回答了13个问题 |采纳率92.3%解题思路:A.食盐颗粒小一些能加快溶解和析出的速率,有利于提纯;
B.设计实验的根据是NaCl的溶解平衡;
C.溶解度只与温度有关;
D.设计实验的根据是NaCl固体在NaCl饱和溶液中的溶解不在增加,而MgCl2在NaCl饱和溶液中溶解未达到饱和.A.NaCl固体在NaCl饱和溶液中的溶解是一种动态平衡,食盐颗粒小一些能加快溶解和析出的速率,有利于提纯,故A错误;
B.设计实验的根据是NaCl固体在NaCl饱和溶液中的溶解不在增加,而MgCl2在NaCl饱和溶液中溶解未达到饱和,因此MgCl2溶解只剩下纯净的NaCl,故B错误;
C.NaCl溶液已达到饱和,浓度不可能变大,故C错误;
D.在饱和NaCl溶液中,NaCl固体的溶解处于平衡状态,溶解和析出同时存在,NaCl溶解的量不会再增加,但对于MgCl2并未达到饱和,因此最后的固体中只会存在NaCl,故D正确.
故选D.点评:
本题考点: 粗盐提纯;物质的分离、提纯的基本方法选择与应用.
考点点评: 本题考查了电解质的溶解平衡知识,难度不大,明确MgCl2和NaCl都是易溶于水的,MgCl2溶解而得到氯化钠固体是本题的关键.1年前查看全部
- 一道粗盐提纯题1.称取一定量的粗盐,研细,放入烧杯中,并加入蒸馏水,加热搅拌,使其溶解.再加入BaCl2溶液和NaOH溶
一道粗盐提纯题
1.称取一定量的粗盐,研细,放入烧杯中,并加入蒸馏水,加热搅拌,使其溶解.再加入BaCl2溶液和NaOH溶液.小心用电炉保温10min,使BaSO4和Mg(OH)2完全沉淀.
2.将纯净氯化氢气体通入已过滤的上述溶液中,直至不再析出NaCl晶体为止,问:通入HCl的目的是________
3.将滤液移入蒸发皿中蒸发,并在通风橱中炒干.炒干的原因是:_________ 甜甜巧克力蛋糕1年前1
甜甜巧克力蛋糕1年前1 -
 helovebb 共回答了18个问题
helovebb 共回答了18个问题 |采纳率100%1.称取一定量的粗盐,研细,放入烧杯中,并加入蒸馏水,加热搅拌,使其溶解.再加入BaCl2溶液和NaOH溶液.小心用电炉保温10min,使BaSO4和Mg(OH)2完全沉淀.
2.将纯净氯化氢气体通入已过滤的上述溶液中,直至不再析出NaCl晶体为止,问:通入HCl的目的是__确保所有组分都以离子形式存在______
3.将滤液移入蒸发皿中蒸发,并在通风橱中炒干.炒干的原因是:____除去夹杂水分_____1年前查看全部
- 粗食盐中常常含有杂质CaCl 2 、MgCl 2 、Na 2 SO 4 和.用粗盐制备精盐时,通常采取溶解、除杂、过滤和
粗食盐中常常含有杂质CaCl 2 、MgCl 2 、Na 2 SO 4 和.用粗盐制备精盐时,通常采取溶解、除杂、过滤和蒸发的操作.其中往粗盐溶液中加入NaOH溶液、Na 2 CO 3 溶液、BaCl 2 溶液和盐酸(均可过量)的目的就是除杂.所加四种溶液的顺序不正确的是( ) A.BaCl 2 、NaOH、Na 2 CO 3 、HCl B.NaOH、BaCl 2 、Na 2 CO 3 、HCl C.Na 2 CO 3 、BaCl 2 、NaOH、HCl D.BaCl 2 、Na 2 CO 3 、NaOH、HCl  yuanyuan7909291年前1
yuanyuan7909291年前1 -
 千机 共回答了13个问题
千机 共回答了13个问题 |采纳率92.3%A、先加氯化钡,除去硫酸根,再加氢氧化钠,除去镁离子,再加碳酸钠,除去多余的钡离子和钙离子,最后加盐酸,除去多余的碳酸钠和氢氧化钠,故A正确;
B、先加氢氧化钠,除去镁离子,再加氯化钡,除去硫酸根,再加碳酸钠,除去钙离子和多余的钡离子,最后加盐酸,除去多余的碳酸钠和氢氧化钠,故B正确;
C、先加过量的碳酸钠,再加过量的氯化钡溶液,多余的钡离子不能被除去,故不能达到目的,故C错误;
D、先加入氯化钡,除去硫酸根,再加碳酸钠,能把钙离子和多余钡离子除去,再加氢氧化钠,除去镁离子,最后加盐酸,除去多余的碳酸钠和氢氧化钠,故D正确.
故选C.1年前查看全部
- 粗盐提纯在实验前为什么要在粗盐溶液加盐酸酸化?
粗盐提纯在实验前为什么要在粗盐溶液加盐酸酸化?
在实验最后为什么要再加盐酸? 雨涵1681年前5
雨涵1681年前5 -
 goluboi 共回答了14个问题
goluboi 共回答了14个问题 |采纳率100%除去碳酸盐杂质
确保制得NACL的纯度1年前查看全部
- 粗盐提纯时看到蒸发皿中存在少量液体时停止加热对不对?必须看到大量固体才行么.
 skali661年前2
skali661年前2 -
 璇子 共回答了24个问题
璇子 共回答了24个问题 |采纳率95.8%将待蒸发的液体放在蒸发皿中,用酒精灯直接加热蒸发皿,边加热边用玻璃棒搅拌,防止局部过热而飞溅.如果需要蒸干,当加热到剩有少量液体时即停止加热,利用余热将剩余水分蒸干.如果是蒸发结晶,则加热到有较多晶体析出时,可停止加热.
粗盐提纯是蒸发结晶则加热到有较多晶体析出时,可停止加热1年前查看全部
- 粗盐中含有氯化钙、氯化镁和硫酸钙杂质,写出出去的有关化学方程式
 任大叫主1年前4
任大叫主1年前4 -
 brf_2003 共回答了11个问题
brf_2003 共回答了11个问题 |采纳率90.9%1、加入过量的氢氧化钡除去氯化镁和硫酸钙
CaSO4+Ba(OH)2=Ca(OH)2+BaSO4↓
MgCl2+Ba(OH)2=Mg(OH)2↓+BaCl2
2、加入过量的碳酸钠除去氯化钙、生成的氢氧化钙和氯化钡及多余的氢氧化钡
Na2CO3+CaCl2=CaCO3↓+2NaCl
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
Na2CO3+BaCl2=BaCO3↓+2NaCl
Na2CO3+Ba(OH)2=BaCO3↓+2NaOH
3、加入过量的盐酸除去生成的氢氧化钠和多余的碳酸钠
NaOH+HCl=NaCl+H2O
Na2CO3+2HCl=2NaCl+CO2↑+H2O
4、加热煮沸除去多余的盐酸.1年前查看全部
- 海水蕴藏着丰富的化学资源.某兴趣小组对海水晒得的粗盐进行提纯并配制NaCl溶液,请回答下列问题:
海水蕴藏着丰富的化学资源.某兴趣小组对海水晒得的粗盐进行提纯并配制NaCl溶液,请回答下列问题:

(1)海水中含有的颜色、异味可以用______除去.
(2)如图为粗盐的提纯过程,其中操作①、②、③依次为______、______、______;玻璃棒的作用依次是______、______、______.
(3)用上述实验所得NaCl晶体配制50g溶质质量分数为5%NaCl溶液,配制时需要的玻璃仪器有烧杯、玻璃棒、滴管、______. 专打旧S筐这ss1年前1
专打旧S筐这ss1年前1 -
 爱薇无悔 共回答了18个问题
爱薇无悔 共回答了18个问题 |采纳率83.3%解题思路:(1)活性炭具有吸附性,能吸附色素和异味.
(2)操作①为:粗盐溶解;操作②含有泥沙的混合液经过过滤,得较纯净的氯化钠溶液;操作③蒸发滤液,得氯化钠晶体.根据玻璃棒的不同作用解答.
(3)要配制5%NaCl溶液50.0g,则可求氯化钠的质量;熟记所需仪器.(1)活性炭具有吸附性,能吸附色素和异味.
(2)精盐中混有不溶性杂质,需经过溶解、过滤除去,然后通过蒸发得到食盐晶体,故操作①②③分别是溶解、过滤、蒸发.溶解时玻璃棒的作用是加快溶解速度,过滤时是引流,蒸发时是防止液滴飞溅
(3)配制时需要的玻璃仪器有烧杯、玻璃棒、滴管、量筒.
故答为:(1)活性炭;(2)溶解;过滤;蒸发;加快溶解速度;引流;防止液滴飞溅;(3)量筒.点评:
本题考点: 氯化钠与粗盐提纯;一定溶质质量分数的溶液的配制;碳单质的物理性质及用途.
考点点评: 掌握溶解、过滤、蒸发等实验的操作技能;理解过滤法分离混合物的化学原理;体会过滤的原理在生活生产等社会实际中的应用.1年前查看全部
- 某同学按照老师要求,配制20g 10%的氯化钠溶液,但是发现实验室没有纯净的氯化钠,只有含泥沙的粗盐.经过与同
某同学按照老师要求,配制20g 10%的氯化钠溶液,但是发现实验室没有纯净的氯化钠,只有含泥沙的粗盐.经过与同学的讨论,打算按如下步骤配制溶液:

步骤一:粗盐提纯
(1)溶解:称取10g粗盐并加水溶解,需要用到上图中哪些仪器______.(填字母)
(2)过滤:在该操作中上图缺少的关键仪器是______.
(3)蒸发结晶:将滤液倒入蒸发皿中加热,当______可以停止连续加热.
(4)在上述三步操作中,均需要用到仪器E,其作用分别是______、______、______.
步骤二:配制溶液
(1)计算:需要氯化钠质量______克,需要水______mL.
(2)称量:用天平称取提纯后所得的精盐,并用______(填仪器名称)量取水.
(3)溶解:溶解时在烧杯中先加入______再加入______.充分溶解后得到的溶液中所含的微粒有______(填微粒符号).
(4)装瓶并贴上标签.
实验反思:
(1)若将20g 10%的氯化钠溶液稀释成5%的溶液,需加水______mL.
(2)该同学配制的溶液经测定溶质质量分数小于10%,下列哪些原因可能引起该误差______
A.提纯后所得的粗盐不纯净,仍然含有可溶性的杂质
B.量取水视线与液体凹液面最低处相平
C.溶液配制好后装入试剂瓶时有部分洒到桌面上
D.称取固体时最终天平指针偏左. wanlinandy1年前1
wanlinandy1年前1 -
 天地合一023 共回答了19个问题
天地合一023 共回答了19个问题 |采纳率89.5%解题思路:步骤一:粗盐提纯
(1)根据溶解需要用到烧杯和玻璃棒进行解答;
(2)根据过滤操作中上图缺少的关键仪器是漏斗进行解答;
(3)根据蒸发结晶:将滤液倒入蒸发皿中加热,当出现较多晶体时可以停止连续加热进行解答;
(4)根据上述三步操作中均需要用到仪器玻璃棒以及其作用进行解答;
步骤二:配制溶液
(1)根据溶质质量分数公式分别求出氯化钠的质量和水的体积进行解答;
(2)根据用量筒来量取水进行解答;
(3)根据实验用品先固体后液体的原则进行解答;
实验反思:
(1)根据溶液稀释过程中溶质质量不变进行解答;
(2)根据配制的溶液经测定溶质质量分数小于10%,可能是溶剂多了或者溶质称重有损失进行解答.步骤一:粗盐提纯
(1)溶解需要用到烧杯和玻璃棒;故填:AE;
(2)过滤操作中上图缺少的关键仪器是漏斗;故填:漏斗;
(3)蒸发结晶:将滤液倒入蒸发皿中加热,当出现较多晶体时可以停止连续加热;故填:出现较多晶体时;
(4)上述三步操作中均需要用到仪器玻璃棒,其作用分别是:加速粗盐的溶解、引流、使液体受热均匀,防止外溅;故填:加速粗盐的溶解;引流;使液体受热均匀,防止外溅;
步骤二:配制溶液
(1)需要氯化钠质量=20g×10%=2g,需要水的质量=20g-2g=18g,所以水的体积18mL;故填:2;18;
(2)用量筒来量取水;故填:量筒;
(3)溶溶解时在烧杯中先加入氯化钠再加入水.充分溶解后得到的溶液中所含的微粒有水分子、钠离子、氯离子;故填:氯化钠;水;H2O、Na+、Cl-;
实验反思:
(1)若将20g 10%的氯化钠溶液稀释成5%的溶液,需加水20mL;故填:20;
(2)配制的溶液经测定溶质质量分数小于10%,可能是提纯后所得的粗盐不纯净,仍然含有可溶性的杂质,而量取水视线与液体凹液面最低处相平和溶液配制好后装入试剂瓶时有部分洒到桌面上,对溶质质量分数无影响,称取固体时最终天平指针偏左会使得溶质质量分数偏大.故填:A;点评:
本题考点: 氯化钠与粗盐提纯;一定溶质质量分数的溶液的配制.
考点点评: 掌握溶解、过滤、蒸发等实验的操作技能;理解过滤法分离混合物的化学原理;体会过滤的原理在生活生产等社会实际中的应用.1年前查看全部
- 通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐.粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化
通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐.粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等).
[提出问题]如何才能将粗盐中难溶性杂质和可溶性杂质(氯化镁、氯化钙)除去,从而获得较纯的食盐晶体?
[资料准备]
[实验方案]某同学为了提纯粗盐,设计了如下实验方案并进行实验.20℃时,一些物质的溶解度 OH - CO 3 2- Na + 溶 溶 Ca 2+ 微 不 Mg 2+ 不 微 
[交流与表达]
(1)实验步骤①和②的目的是______;实验步骤③和④的目的是______.
(2)实验操作X的名称是______,该操作中要用到的玻璃仪器有烧杯、玻璃棒和______.
(3)实验步骤③的主要目的是______(用化学方程式回答);判断氢氧化钠溶液已过量的方法是______.
(4)实验步骤④中生成的沉淀D是______.
(5)实验步骤⑤用蒸发溶剂的方法而不用降低溶液温度的方法获取食盐晶体,原因是______;在蒸发食盐溶液的过程中要使用玻璃棒,作用是______.
[反思与评价]
(6)有同学认为只需要用氢氧化钠溶液和碳酸钠溶液中任意一种试剂就能将两种可溶性杂质出去,你认为这种方法______(选填“可行”或“不可行”),理由是______.
(7)有同学认为原实验方案不完善,做出这种评价的依据是______.
[实验方案设计]
(8)为了完善原实验方案,你设计的实验是______(仅写出补充部分的实验操作和现象) 原野ee1年前1
原野ee1年前1 -
 海底的老鹰 共回答了24个问题
海底的老鹰 共回答了24个问题 |采纳率70.8%(1)通过溶解、过滤可以把粗盐中不溶性杂质除去.
故填:除去粗盐中的难溶性杂质.
通过步骤③和④,可以除去粗盐中的易溶性杂质CaCl 2 、MgCl 2 .
故填:除去粗盐中的易溶性杂质CaCl 2 、MgCl 2 .
(2)实验操作X的名称是过滤,该操作中要用到的玻璃仪器有烧杯、玻璃棒和漏斗.
故填:过滤;漏斗.
(3)实验步骤③的主要目的是除去氯化镁,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,反应的化学方程式为:MgCl 2 +2NaOH═Mg(OH) 2 ↓+2NaCl.
故填:MgCl 2 +2NaOH═Mg(OH) 2 ↓+2NaCl.
判断氢氧化钠溶液已过量的方法是:取样品少许,加入试管中,滴加酚酞试液,溶液变红色.
故填:取样品少许,加入试管中,滴加酚酞试液,溶液变红色.
(4)实验步骤④中生成的沉淀D是碳酸钙.
故填:碳酸钙.
(5)实验步骤⑤用蒸发溶剂的方法而不用降低溶液温度的方法获取食盐晶体,原因是氯化钠的溶解度受温度影响较小.
故填:氯化钠的溶解度受温度影响较小.
在蒸发食盐溶液的过程中要使用玻璃棒,作用是搅拌溶液,避免因局部过热,造成液滴飞溅.
故填:搅拌溶液,避免因局部过热,造成液滴飞溅.
(6)这种方法不可行,因为MgCO 3 、Ca(OH) 2 均为微溶物,只用任意一种试剂就会有一种杂质生成微溶物而不能全部除去.
故填:不可行;MgCO 3 、Ca(OH) 2 均为微溶物,只用任意一种试剂就会有一种杂质生成微溶物而不能全部除去.
(7)做出这种评价的依据是:在除去MgCl 2 和CaCl 2 的同时,又引入了新的杂质NaOH和Na 2 CO 3 .
故填:在除去MgCl 2 和CaCl 2 的同时,又引入了新的杂质NaOH和Na 2 CO 3 .
(8)设计的实验是:向溶液C中逐滴加入稀盐酸至不再产生气泡,滴加酚酞试液时溶液不变色.
故填:向溶液C中逐滴加入稀盐酸至不再产生气泡,滴加酚酞试液时溶液不变色.1年前查看全部
- (2006•崇文区一模)(1)如图A为进行粗盐提纯实验中,过滤操作的示意图,试回答:
(2006•崇文区一模)(1)如图A为进行粗盐提纯实验中,过滤操作的示意图,试回答:
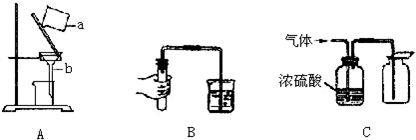
①写出仪器名称:a______;b______;
②进行过滤操作时要使液体沿______流入过滤器,漏斗中液体的液面应该(填“高”或“低”)______于滤纸的边缘.
(2)如图B实验操作的目的是______.
(3)能用图C装置干燥并收集的气体应具有的性质是______. 多情_浪子1年前1
多情_浪子1年前1 -
 伸吊瞎驴 共回答了19个问题
伸吊瞎驴 共回答了19个问题 |采纳率78.9%解题思路:(1)据常用仪器回答;并据过滤操作的注意事项‘一贴二低三靠’分析解答;
(2)检查装置气密性,防止装置漏气;
(3)能用浓硫酸干燥的气体说明该气体不与浓硫酸反应,用向上排空气法收集的气体说明其密度比空气大且不与空气中成分发生反应.(1)①图示仪器分别是烧杯和漏斗;
②过滤操作时要使液体沿玻璃棒流入过滤器,防止液体溅出,漏斗中液体的液面应该低于滤纸的边缘,防止不溶性物质从滤纸和漏斗间的缝隙流下,达不到过滤的目的;
(2)图示操作是检查装置气密性,防止装置漏气;
(3)能用浓硫酸干燥的气体说明该气体不与浓硫酸反应,用向上排空气法收集的气体说明其密度比空气大;
故答案为:(1)①烧杯;漏斗;②玻璃棒;低;
(2)检查装置的气密性;
(3)不与硫酸反应;密度比空气大,点评:
本题考点: 过滤的原理、方法及其应用;检查装置的气密性;气体的干燥(除水).
考点点评: 本题难度不大,属于基础实验考查题,了解过滤操作注意事项、气密性检查、气体的干燥和收集知识是解答问题的关键.1年前查看全部
- 用①NaOH,②Na2CO3,③BaCl2和稀盐酸,除去粗盐中的氯化镁,氯化钙和硫酸钠的正确顺序,以及原因
 海边听浪1年前4
海边听浪1年前4 -
 chenyan8241 共回答了16个问题
chenyan8241 共回答了16个问题 |采纳率100%③②①④
加氯化钡先,因为钡离子有毒,而且氯化钡较贵.只要稍微过量即可去掉硫酸根.
然后加碳酸钠,可以去掉钙离子钡离子和大部分镁离子.
碳酸镁微溶,加氢氧化钠可以进一步去除镁离子.
过滤之后,最后加盐酸,去掉氢氧根,碳酸根.只剩下氯化钠了.
只要蒸干即可.
希望能解决你的疑问☆⌒_⌒☆1年前查看全部
- 出去粗盐中的Ca离子,Mg离子,SO4离子时若先用盐酸调pH在过滤会产生什么影响
 T最后的ll1年前3
T最后的ll1年前3 -
 绘野 共回答了19个问题
绘野 共回答了19个问题 |采纳率84.2%固体可能溶解了1年前查看全部
- 用下图操作可完成甲、乙两个实验.甲实验为配制溶质的质量分数为20%的氯化钠溶液,乙实验为粗盐中难溶性杂质的去除.下列说法
用下图操作可完成甲、乙两个实验.甲实验为配制溶质的质量分数为20%的氯化钠溶液,乙实验为粗盐中难溶性杂质的去除.下列说法中,正确的是( ) 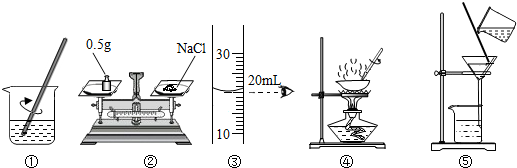
A.甲实验按照②③①的步骤,如图所示操作,配制的溶液浓度偏小 B.甲实验操作顺序为②③①,②①如图所示操作,操作③在读取体积时仰视了,配制的溶液浓度偏大 C.乙实验各步操作中的玻璃棒都是用来搅拌的 D.乙实验的步骤是①⑤④,其中④当蒸发皿中出现较多固体时,就停止加热  我爱木头1年前1
我爱木头1年前1 -
 fishsilk 共回答了13个问题
fishsilk 共回答了13个问题 |采纳率92.3%A、甲实验配制溶液时,先称量,再量取、最后溶解,所以按照②③①的步骤进行,由于没有移动游码,所以左码右物和左物右码称得的质量相同,配制溶液的浓度不变,故A错;
B、操作③在读取体积时仰视了,量取到的水体积偏大,所以配制溶液浓度偏小,故B错;
C、过滤时玻璃棒的作用是引流,故C错;
D、粗盐提纯的步骤是溶解、过滤、蒸发,所以乙实验的步骤是①⑤④,其中④当蒸发皿中出现较多固体时,就停止加热,靠余热使剩余的固体结晶析出,故D正确.
故选D.1年前查看全部
- (2011•南京一模)某化学兴趣小组设计出下列粗盐提纯的实验方案,请你一起来完成以下问题.
(2011•南京一模)某化学兴趣小组设计出下列粗盐提纯的实验方案,请你一起来完成以下问题.
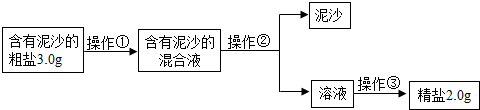
(1)操作①②③的名称依次是溶解溶解、过滤过滤、蒸发蒸发;若在操作②结束后发现溶液仍浑浊,应采取的措施是重新过滤(重新实验)重新过滤(重新实验).
(2)实施操作③时玻璃棒要不断搅拌,直到出现较多固体出现较多固体时停止加热;
(3)计算精盐的产率是66.7%66.7%(计算结果取小数点后一位);
(4)若精盐的产率偏低,则可能的原因是BDBD(填字母序号)
A.过滤时滤纸有破损
B.蒸发时有固体溅出
C.溶解含有泥沙的粗盐时,加入的水量过多
D.转移精盐时,蒸发皿中有残留的固体. 小小-萤火虫1年前1
小小-萤火虫1年前1 -
 yhfjj 共回答了16个问题
yhfjj 共回答了16个问题 |采纳率87.5%解题思路:(1)根据粗盐提纯的步骤回答;(2)根据蒸发时的操作回答;(3)根据精盐和粗盐的质量计算产率;(4)从氯化钠损失的角度分析.(1)根据图示和粗盐的提纯步骤,操作①②③的名称依次是溶解、过滤、蒸发;若发现溶液仍浑浊,应采取的措施是重新再过滤一次.
(2)蒸发时,当蒸发皿中出现较多固体时停止加热;
(3)精盐的产率是
2g
3g×100%=66.7%;
(4)若精盐的产率偏低,则可能的原因是蒸发时有固体溅出或转移精盐时,蒸发皿中有残留的固体.
故答案为:(1)溶解、过滤、蒸发;重新过滤(重新实验)
(2)出现较多固体
(3)66.7%
(4)BD点评:
本题考点: 氯化钠与粗盐提纯.1年前查看全部
- 华罗庚先生推广的统筹法、优选法使不少企业的经济效益大大提高,列如当年的天津碱厂,纯碱生产优选后,每年可节约粗盐9000吨
华罗庚先生推广的统筹法、优选法使不少企业的经济效益大大提高,列如当年的天津碱厂,纯碱生产优选后,每年可节约粗盐9000吨,若当时粗盐以每千克0.03元计算,则每年可节约______元(用科学记数法表示)
 ee曾记过客1年前1
ee曾记过客1年前1 -
 沙漠孙子 共回答了17个问题
沙漠孙子 共回答了17个问题 |采纳率70.6%解题思路:科学记数法的表示形式为a×10n的形式,其中1≤|a|<10,n为整数.确定n的值时,要看把原数变成a时,小数点移动了多少位,n的绝对值与小数点移动的位数相同.当原数绝对值>1时,n是正数;当原数的绝对值<1时,n是负数.9000吨=9000000千克,
9000000×0.03=270000元=2.7×105元.
故答案为:2.7×105.点评:
本题考点: 科学记数法—表示较大的数.
考点点评: 本题考查科学记数法的表示方法.科学记数法的表示形式为a×10n的形式,其中1≤|a|<10,n为整数,表示时关键要正确确定a的值以及n的值.1年前查看全部
- 在20摄氏度时,要提纯50g含有少量泥沙的粗盐,最好用多少水来溶解粗盐?
 lovenakata1年前1
lovenakata1年前1 -
 龙用忍 共回答了13个问题
龙用忍 共回答了13个问题 |采纳率92.3%10℃时,氯化钠的溶解度为36克,用10克水溶解3.6克氯化钠恰好达到饱和.
NaCl在温度变化的时候溶解度变化不是很大 具体的你还是查下氯化钠的溶解度吧
大概是139g左右1年前查看全部
- 怎样判断纯净物比如胆矾、粗盐、硫酸、汽水、蒸馏水、果汁、空气、冰水混合物,哪些是纯净物?这是怎么判断的?
 梧桐细雨黄昏1年前2
梧桐细雨黄昏1年前2 -
 txpws 共回答了14个问题
txpws 共回答了14个问题 |采纳率92.9%胆矾,硫酸,蒸馏水,冰水混合物是纯净物
粗盐,汽水,果汁,空气是混合物
纯净物是有一种物质组成的,混合物是由多种物质组成的
顺便提醒下,稀硫酸和浓硫酸是混合物,光说硫酸是纯净物1年前查看全部
- (2013•长春二模)工业制取的粗盐(NaCl)中常混有MgCl2、CaCl2,欲分离提纯加以利用,实验过程如图:
(2013•长春二模)工业制取的粗盐(NaCl)中常混有MgCl2、CaCl2,欲分离提纯加以利用,实验过程如图:
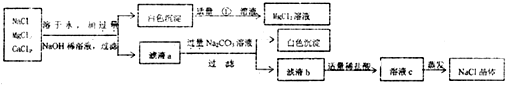
(1)将粗盐溶于水,加入过量氢氧化钠将氯化镁转化为沉淀后过滤,再向滤出的沉淀中加入适量的______,得到氯化镁,使氯化镁得以分离再利用;
(2)在滤液b中加入适量盐酸的目的是______,如果滴加的稀盐酸过量,对最后得到的精盐的成分______影响(选填“有”或“没有”) 妙不可言61年前1
妙不可言61年前1 -
 控制面板2 共回答了11个问题
控制面板2 共回答了11个问题 |采纳率90.9%解题思路:(1)氢氧化镁沉淀能与稀硫酸反应,生成氯化镁;
(2)盐酸能与氢氧化钠反应生成氯化钠,盐酸溶质氯化氢沸点低,稀盐酸过量,对最后得到的精盐的成分没有影响;(1)氢氧化镁沉淀能与稀硫酸反应,生成氯化镁;
(2)盐酸能与氢氧化钠反应生成氯化钠,故在滤液b中加入适量盐酸的目的是把氢氧化钠转化为氯化钠;盐酸溶质氯化氢沸点低,在蒸发过程中早已跑掉,故稀盐酸过量,对最后得到的精盐的成分没有影响;
答案:(1)稀盐酸;
(2)把氢氧化钠转化为氯化钠,没有;点评:
本题考点: 氯化钠与粗盐提纯;酸的化学性质;盐的化学性质.
考点点评: 本题涉及知识点比较多,要求学生有完整的知识结构和分析问题的能力并对课本知识能够牢固的掌握.1年前查看全部
- 配置50g 6%的氯化钠溶液 实验中 如果量取水时仰视刻度 则所配置的溶液溶质的质量分数——6%(填> ,< 或=)粗盐
配置50g 6%的氯化钠溶液 实验中 如果量取水时仰视刻度 则所配置的溶液溶质的质量分数——6%(填> ,< 或=)粗盐提纯的实验操作有:a过滤 b溶解 c蒸发结晶
其正确的顺序是——(填序号) 上述两个实验都用到的仪器——(填写两种仪器名称) 就不信射不nn你1年前1
就不信射不nn你1年前1 -
 bb有李 共回答了14个问题
bb有李 共回答了14个问题 |采纳率92.9%配置50g 6%的氯化钠溶液 实验中 如果量取水时仰视刻度 则所配置的溶液溶质的质量分数—< —6%(填> , < 或=)粗盐提纯的实验操作有:a过滤 b溶解 c蒸发结晶
其正确的顺序是—b a c —(填序号) 上述两个实验都用到的仪器—烧杯 玻璃棒—(填写两种仪器名称)1年前查看全部
- 化学实验室欲除去粗盐中混有的少量不溶性杂质,请回答下列有关问题(1)其正确的操作步骤是[1] [2] [3] (
 tyh_48061年前1
tyh_48061年前1 -
 qlezh 共回答了20个问题
qlezh 共回答了20个问题 |采纳率95%一,要有绵纸做成漏斗状
二,把粗盐用水溶解到入漏斗状的绵纸里滤下的盐水用容器接住
三,把接下的盐水烧干后等到的盐就是纯净的盐1年前查看全部
- 从海水中得到的粗盐中含有Mg2+,Ca2+,SO4 2+ 等杂质离子,如果用试剂BaCl2,NaOH,盐酸和NaCO3溶
从海水中得到的粗盐中含有Mg2+,Ca2+,SO4 2+ 等杂质离子,如果用试剂BaCl2,NaOH,盐酸和NaCO3溶液,除去杂质离子,则加入的试剂顺序是什么
 zhlyyyyy1年前3
zhlyyyyy1年前3 -
 xylymj 共回答了18个问题
xylymj 共回答了18个问题 |采纳率94.4%先加BaCl2除去SO4 2- 再加OH-除去Mg2+ 再加Na2CO3除去Ca2+ 最后加盐酸除去过量的OH-和Na2CO3
Ba2+在加入Na2CO3时已经除去了 氢氧化镁的溶解度小于碳酸镁 所以要用氢氧根除镁离子1年前查看全部
- 粗盐提纯的六个方程式我写的之后还有的是什么?
粗盐提纯的六个方程式我写的之后还有的是什么?
BaCl2 + Na2SO4 === BaSO4↓+ 2H2O
Na2CO3 + BaCl2 === BaCO3↓+ 2NaCl
MgCl2 + 2NaOH == Mg(OH)2↓+2NaCl
Na2CO3 + 2HCl == 2NaCl + CO2↑ + H2O ralfz1年前1
ralfz1年前1 -
 梦之翼 共回答了20个问题
梦之翼 共回答了20个问题 |采纳率100%少量这个:Na2CO3 + CaCl2 === CaCO3↓+ 2NaCl1年前查看全部
- 初中化学粗盐结晶什么的 求戳进这道题不管答案如何,其实我就想问一个问题.前面过量的NaOH溶液 能否也用Na2CO3溶
初中化学粗盐结晶什么的 求戳进
这道题不管答案如何,其实我就想问一个问题.
前面过量的NaOH溶液 能否也用Na2CO3溶液呢?一样会产生碳酸镁沉淀不是?有何不妥?

图看不清请和我说.
 股怪柏麟1年前1
股怪柏麟1年前1 -
 tianyageshou 共回答了13个问题
tianyageshou 共回答了13个问题 |采纳率100%MgCO3微溶于水而Mg(OH)2难溶于水用Na2CO3效及用NaOH效好,S所以不可1年前查看全部
- 如何将粗盐变成精盐?请给出一个实验设计。包括原理、所用到的用品、步骤还有预期。
 cmecty1年前1
cmecty1年前1 -
 千﹎雨凡 共回答了22个问题
千﹎雨凡 共回答了22个问题 |采纳率90.9%过滤,然后加氢氧化钠出去镁离子,过滤,再加入碳酸钡出去硫酸根,然后加入碳酸钠出去钡离子和钙离子,过滤,再加入过量稀盐酸除去碳酸根,过滤蒸馏.1年前查看全部
- 粗盐提纯的方程式
 排骨牛1年前1
排骨牛1年前1 -
 提那 共回答了18个问题
提那 共回答了18个问题 |采纳率94.4%混合物溶解如水中,则可过滤碳酸钙和泥沙.
然后加入足量的稀盐酸,除去碳酸钠.
最后加热,除去水和多余的盐酸.
得到氯化钠.
具体的是这样
一、实验目的
1.掌握溶解、过滤、蒸发等实验的操作技能.
2.理解过滤法分离混合物的化学原理.
3.体会过滤的原理在生活生产等社会实际中的应用.
[编辑本段]二、实验仪器和药品
药品:粗盐,水
器材:托盘天平,量筒,烧杯,玻璃棒,药匙,漏斗,铁架台(带铁圈),蒸发皿,酒精灯,坩埚钳,胶头滴管,
滤纸,剪刀,火柴,纸片
[编辑本段]三、实验原理
粗盐中含有泥沙等不溶性杂质,以及可溶性杂质如:等.不溶性杂质可以用溶解、过滤的方法
除去,然后蒸发水分得到较纯净的精盐.
[编辑本段]四、实验操作
1.溶解
用托盘天平称取5克粗盐(精确到0.1克).用量筒量取10毫升水倒入烧杯里.用药匙取一匙粗盐加入水中,观察发生的现象.用玻璃棒搅拌,并观察发生的现象(玻璃棒的搅拌对粗盐的溶解起什么作用?).接着再加入粗盐,边加边用玻璃棒搅拌,一直加到粗盐不再溶解时为止.观察溶液是否浑浊.
在天平上称量剩下的粗盐,计算在10毫升水中大约溶解了多少克粗盐.
2.过滤
按照化学实验基本操作6所述方法进行过滤.仔细观察滤纸上的剩余物及滤液的颜色.滤液仍浑浊时,应该再过滤一次.
如果经两次过滤滤液仍浑浊,则应检查实验装置并分析原因,例如,滤纸破损,过滤时漏斗里的液面高于滤纸边缘,仪器不
干净等.找出原因后,要重新操作.
3.蒸发
把得到的澄清滤液倒入蒸发皿.把蒸发皿放在铁架台的铁圈上,用酒精灯加热(图20).同时用玻璃棒不断搅拌滤液(防止溶液迸溅).
等到蒸发皿中出现较多量固体时,停止加热.利用蒸发皿的余热使滤液蒸干.
4.用玻璃棒把固体转移到纸上,称量后,回收到教师指定的容器.比较提纯前后食盐的状态并计算精盐的产率.
5.粗盐中含有Mg2+、Ca2+、SO42-
去除可溶性杂质:
溶解
加入过量BaCl2(去除硫酸根离子)SO42-+Ba2+=BASO4
加入过量NaOH(去除镁离子)Mg2++2OH-=Mg(OH)2
加入过量Na2CO3(去除钙离子及BaCl2中的钡离子) Ca2+CO32-=CaCO3
Ba2+CO32-=BaCO3
过滤
往滤液中加入适量HCl(除去过量NAOH,可用pH试纸控制加入的量)
蒸发,结晶1年前查看全部
- 粗盐提纯顺序问题我不懂为何要这样的顺序?这几步除了(溶解和过滤)感觉全可以颠倒啊
 你大哥1年前2
你大哥1年前2 -
 as852 共回答了12个问题
as852 共回答了12个问题 |采纳率83.3%请问“这样的顺序”是怎样的顺序?
总之,全部操作是
1,加水溶解
2、过滤,得滤液
3、蒸发结晶
具体是这三部,至于有什么别的操作都是多余的.上面散步的顺序不可换.1年前查看全部
- 粗盐提纯实验过程中,有哪些操作可能使食盐受热损失?
 开心吉它手1年前1
开心吉它手1年前1 -
 cnwuhao 共回答了10个问题
cnwuhao 共回答了10个问题 |采纳率100%最主要的是:加热时间太长,食盐晶体形成后继续加热,晶体会受热飞溅出蒸发皿.应该加热至有较多固体析出是即停止加热,利用余热使剩余水分蒸发掉.另外,加热时应用玻璃棒不断搅拌,防止局部过热使固体飞溅,造成损失.1年前查看全部
- 让我郁闷了N久的几道化学题.1.某粗盐样品中含有可溶性的氯化镁、氯化钙杂质和不溶性的泥沙.常温下,将140 g该粗盐样品
让我郁闷了N久的几道化学题.
1.某粗盐样品中含有可溶性的氯化镁、氯化钙杂质和不溶性的泥沙.常温下,将140 g该粗盐样品溶解于水中,过滤得到不足3 g泥沙和1000 g溶液.取出500 g溶液进行测定,其中含有镁元素1.2 g,钙元素2 g,氯元素42.6 g.则原粗盐中氯化钠的质量分数约为( )
A.83.6% B.86.3% C.88.1% D.91.6%
2.已知t°C时,氯化钾的溶解度为40g.在该温度下,将20g氯化钾固体加入到50g水中,充分溶解,形成的溶液中溶质的质量分数为( )
A.25% B.28.6% C.33.3% D.50%
我知道答案是什么,
请说明为什么. 拓拔路儿1年前1
拓拔路儿1年前1 -
 爱你很痛 共回答了24个问题
爱你很痛 共回答了24个问题 |采纳率79.2%1.A
500 g溶液中:
镁元素1.2 g来自于 MgCl2.
MgCl2中Mg的质量分数:24/(35.5*2+24) 所以MgCl2质量为4.75g
所以MgCl2中Cl的质量:4.75g-1.2 g=3.55g
钙元素2 g来自于CaCl2
CaCl2中Ca的质量分数:40/(40+35.5*2) 所以 CaCl2质量为5.55g
所以CaCl2中Cl的质量:5.55g-2 g=3.55g
氯元素42.6 g来自于MgCl2,CaCl2,NaCl
NaCl中Cl的质量:42.6 g-3.55g-3.55g=35.5g
所以NaCl的质量为58.5g(方法和前面的一样)
500 g溶液中NaCl的质量为58.5g.1000 g溶液中NaCl的质量为117g
溶液一共140g.质量分数:117/140=83.6%
选A
2.B
氯化钾的溶解度为40g :t°时100g水中可以溶解40gKCl
将20g氯化钾固体加入到50g水中,就恰好可以完全溶解
质量分数:20/(50+20)=28.6%
选B1年前查看全部
- 根据粗盐提纯的实验回答下列问题.
根据粗盐提纯的实验回答下列问题.
(1)请写出实验的主要步骤:①______②______③______④______.
(2)前三个步骤中都用到了______,其作用分别是①______②______③______. srfrefres1年前1
srfrefres1年前1 -
 hz0904 共回答了21个问题
hz0904 共回答了21个问题 |采纳率81%解题思路:粗盐的初步提纯步骤:目的是除去泥沙,所以可通过①溶解:用玻璃棒搅拌;②过滤:注意“一贴二低三靠”,用玻璃棒引流;③蒸发:用玻璃棒搅拌,避免液体局部过热造成液滴飞溅;④重结晶.(1)粗盐的初步提纯,目的是除去泥沙,所以可通过①溶解,②过滤:注意“一贴二低三靠”,③蒸发,④重结晶等主要步骤;
(2)前三个步骤都用到玻璃棒,玻璃棒的作用是:溶解时,用玻璃棒搅拌加快溶解速度;过滤时用玻璃棒引流,将液体引入过滤器内;蒸发时用玻璃棒搅拌,避免液体局部过热造成液滴飞溅.
故答案为:
(1)①溶解 ②过滤 ③蒸发 ④重结晶;
(2)玻璃棒 ①搅拌,加快食盐溶解 ②引流,将液体引入过滤器内 ③搅拌,避免液体局部过热造成液滴飞溅.点评:
本题考点: 氯化钠与粗盐提纯;过滤的原理、方法及其应用;常用仪器的名称和选用.
考点点评: 在解此类题时,首先要分析各种操作步骤的作用,然后结合选项中的顺序进行分析解答.1年前查看全部
- 如果要除去粗盐中含有的可溶性杂质氯化钙,氯化镁及一些硫酸钠,应加入什么试剂?
如果要除去粗盐中含有的可溶性杂质氯化钙,氯化镁及一些硫酸钠,应加入什么试剂?
三种方法
 taxismile1年前1
taxismile1年前1 -
 ll101 共回答了15个问题
ll101 共回答了15个问题 |采纳率86.7%先加过量氯化钡 生成硫酸钡沉淀,除掉硫酸根离子; 再加过量 碳酸钠,生成 钡离子 钙离子 镁离子的硫酸盐沉淀,将它们全都除掉了 ,再加过量盐酸就可以了中和多余的碳酸钠,最后加热 使盐酸挥发掉就可以1年前查看全部
- 初三化学:实验检验粗盐中含有较多的CaCl2
初三化学:实验检验粗盐中含有较多的CaCl2
九年级的化学题: 检验粗盐中含有较多的CaCl2.请设计实验验证是否含有该杂质.1.操作步骤:2.实验现象:3.实验结论: 怎么做?老师们快帮帮忙啊
 qingzhi09291年前1
qingzhi09291年前1 -
 淡竹清雪 共回答了22个问题
淡竹清雪 共回答了22个问题 |采纳率81.8%也许楼上的对
不过我的个人想法是
如果这道题的出题者不是把这个题目弄得这么简单
那就错了 因为其中会有Ba2+的干扰
所以我个人觉得应该用草酸处理
由于草酸钡是可溶性物质
有沉淀就可以排除Ba+干扰1年前查看全部
- (2010•乐山)实验小组的同学欲对一粗盐样品进行初步提纯.所用实验仪器或用品如下:
(2010•乐山)实验小组的同学欲对一粗盐样品进行初步提纯.所用实验仪器或用品如下:
(1)A的名称是______;
(2)提纯的步骤是:溶解、过滤、______、计算产率;
(3)“过滤”操作的要点可概括为“一贴、二低、三靠”,其中“二低”的含义是______;
(4)实验小组通过正确的计算发现,所得实验结果对与该粗盐的实际含量对比,实验测得的结果比实际偏低,请分析可能的原因:______. 泪娃子1年前1
泪娃子1年前1 -
 噩梦鬼魅 共回答了25个问题
噩梦鬼魅 共回答了25个问题 |采纳率84%解题思路:(1)根据题中所给的装置及常见的化学仪器进行分析,
(2)根据粗盐提纯的步骤进行解答,
(3)根据过滤时的操作要点进行分析解答,
(4)可以从导致精盐减少的原因进行分析解答,(1)A是用来支撑装置过滤、支撑蒸发皿进行加热的,故答案为:铁架台,
(2)在粗盐提纯的实验中需要将滤液蒸发水分后得到精盐,然后计算产率,故答案为:蒸发,
(3)两低主要是为了防止滤液漫过漏斗、漫过滤纸而起不到过滤的目的,故答案为:滤纸边缘低于漏斗边缘,滤液液面低于滤纸边缘,
(4)精盐的质量偏少,在过滤、蒸发操作时损失了液体的质量,故答案为:蒸发时,液滴飞溅;称量时操作或读数错误点评:
本题考点: 氯化钠与粗盐提纯;实验数据处理或者误差分析的探究;过滤的原理、方法及其应用;常用仪器的名称和选用.
考点点评: 本题主要对粗盐的提纯实验进行了全面的考查,以及对实验数据所产生的误差能够正确的分析.1年前查看全部
- 粗盐提纯方程式及步骤就是出去其中可溶性的盐的步骤,分别要加什么,为什么加还有加的顺序及原因
 sunny_star881年前1
sunny_star881年前1 -
 我来下电影 共回答了13个问题
我来下电影 共回答了13个问题 |采纳率100%⑴、粗盐中含有较多的可溶性杂质(CaCl2、MgCl2等)和不溶性杂质(泥沙等).可通过什么方法来制取精盐?
除去可溶性杂质,一般是选择一种或几种化学试剂将这些可溶性杂质反应掉,同时不能生成新的杂质.除去不溶性杂质一般通过溶解、过滤、蒸发三个步骤来实现.
⑵、实验前所称量的粗盐不宜过多,否则会出现过剩的现象,影响提纯的质量.溶解时要注意及时搅拌,以使粗盐能够完全溶解到水中.
⑶、过滤时要注意“一贴、两低、三靠”.建议在过滤前先静置一会儿,过滤时先让上层滤液滤过,再将混有泥沙的溶液倒入漏斗中.如果一起倒入会造成滤纸的堵塞,减缓过滤的速度.
步骤:
加入BaCl2,产生白色沉淀,至白色沉淀不再增加时停止,虑出沉淀BaSO4,除去杂质SO42-;
加入Na2CO3,产生白色沉淀,至白色沉淀不再增加时停止,虑出沉淀CaCO3,除去杂质Ca2+;
加入NaOH,产生白色沉淀,至白色沉淀不再增加时停止,虑出沉淀Mg(OH)2,Ba(OH)2;
最后加入HCl至溶液呈中性.1年前查看全部
- 食盐在化工等领域都有哪些应用?我家靠海有很多盐场,请问粗盐除了用于食品盐加工外还用那些可开发的用途
 雷冲1年前2
雷冲1年前2 -
 菠菜罐头 共回答了18个问题
菠菜罐头 共回答了18个问题 |采纳率94.4%盐化学专业,氯碱工业等是以盐为主的化工工业大族.
盐在工业上用途很广的,大部分用于生产纯碱、烧碱、氯气、盐酸、金属钠等基础原料.1年前查看全部
- (2014•苏州)有关粗盐提纯的实验操作合理的是( )
(2014•苏州)有关粗盐提纯的实验操作合理的是( )
A.溶解前用玻璃棒研磨大颗粒粗盐
B.过滤时液体的液面要低于滤纸边缘
C.加热蒸发时要不断搅拌直至水分全部蒸干
D.实验结束随即用手将蒸发皿从三脚架上取下 yuxuwen2011年前1
yuxuwen2011年前1 -
 0mfz 共回答了11个问题
0mfz 共回答了11个问题 |采纳率100%解题思路:A、根据玻璃棒不能研磨固体进行分析;
B、根据过滤时,漏斗中液体的液面应低于滤纸边缘进行分析;
C、根据蒸发皿中出现多量固体时,就停止加热,利用余热蒸干晶体进行分析;
D、根据实验结束时,蒸发皿的温度较高进行分析.A、玻璃棒不能研磨大颗粒粗盐,容易使玻璃棒折断,应该用研杵,故A错误;
B、过滤时,漏斗中液体的液面应低于滤纸边缘,故B正确;
C、蒸发皿中出现多量固体时,就停止加热,利用余热蒸干晶体,故C错误;
D、实验结束时,蒸发皿的温度较高,会将手烫伤,故D错误.
故选:B.点评:
本题考点: 氯化钠与粗盐提纯;过滤的原理、方法及其应用;常用气体的发生装置和收集装置与选取方法.
考点点评: 本题主要考查了过滤操作中的注意事项,难度不大,依据课本知识即可完成.1年前查看全部
- 在电解食盐水之前,需要提纯食盐水.为了除去粗盐中的钙离子镁离子硫酸根离子及泥沙.要不同的方法!
 羊咩咩05261年前1
羊咩咩05261年前1 -
 guan12 共回答了19个问题
guan12 共回答了19个问题 |采纳率94.7%先过滤除去泥沙,然后滴入氯化钡除去硫酸根离子,再加入氢氧化钠除去镁离子,最后通过碳酸钠出去钙离子.
既然要除去粗盐中的杂质,就不能引进其他的杂质,例如:氢氧化钾也可以除去镁离子,但除去后又要考虑除去钾离子.所以一般除去杂质不能引入其他杂质的.1年前查看全部
- 一道基本的化学计算题~已知粗盐样品中含NACL为90%,其余为MgCL2,用一定量的该粗盐与足量的浓H2SO4反应并加强
一道基本的化学计算题~
已知粗盐样品中含NACL为90%,其余为MgCL2,用一定量的该粗盐与足量的浓H2SO4反应并加强热,将产生的HCL气体全部溶于水配成100ML溶液.取10ML此溶液与足量AgNO3溶液反应生成白色沉淀14.35g,
求:
实验时取粗盐样品多少克? 心又悦宇1年前2
心又悦宇1年前2 -
 bob135jm 共回答了22个问题
bob135jm 共回答了22个问题 |采纳率95.5%生成的白色沉淀为AgCl,HCl:AgCl=36.5:143.5,
由此,可得:mHCl=14.35g×36.5/143.5=3.65g
所以原溶液中含有HCl=3.65g×10mL/100mL=36.5g
MgCl2与H2SO4反应生成2HCl,所以原样品中有MgCl2:
mMgCl2=36.5g×95/73=47.5g
对应的质量分数是(1-90%)=10%
所以原样品的质量是475g1年前查看全部
- 用含有少量氯化钙的氯化钠固体,配制质量分数为 10%的氯化钠溶液,设计如图所示操作方案,根据下图回答: ⑴称量粗盐样品1
用含有少量氯化钙的氯化钠固体,配制质量分数为 10%的氯化钠溶液,设计如图所示操作方案,根据下图回答: 
⑴称量粗盐样品10克时,托盘天平右盘放___________ 。
⑵过滤时,过滤器内的液面要低于___________。
⑶蒸发操作应在__________中加热,待出现___________时停止加热。
⑷用化学方程式表示过量盐酸的作用___________
⑸配制10%氯化钠溶液时,加水的量是_________克,配制溶液时应在_________中进行。 铁血亦柔情1年前1
铁血亦柔情1年前1 -
 hole 共回答了18个问题
hole 共回答了18个问题 |采纳率88.9%⑴砝码
⑵滤纸边缘
⑶蒸发皿;较多量固体
⑷Na 2 CO 3 +2HCl==2NaCl +H 2 O +CO 2 ↑
⑸72;烧杯1年前查看全部
- 粗盐提纯 为什么要在碳酸钠之前加入氯化钡
粗盐提纯 为什么要在碳酸钠之前加入氯化钡
如果先加入碳酸钠,CaCl2+Na2CO3=2NaCl+CaCO3 再加氯化钡,Na2SO4+BaCl2=BaSO4+2NaCl 这样碳酸钙和硫酸钡除去,过量的氯化钡和碳酸钠也可以互相反应除去啊,BaCl2+Na2CO3=BaCO3+2NaCl,生成碳酸钡沉淀
为什么说先加碳酸钠多余的钡离子就不能除去呢? niuchuyan1年前2
niuchuyan1年前2 -
 chuangchee 共回答了15个问题
chuangchee 共回答了15个问题 |采纳率86.7%先加碳酸钠,CaCl2+Na2CO3=2NaCl+CaCO3 保证除尽,应加过量
再加氯化钡,Na2SO4+BaCl2=BaSO4+2NaCl BaCl2+Na2CO3=2NaCl+BaCO3 (沉淀) 两个都是生成沉淀,不知道硫酸钠什么时候反应完.为保证除尽,也应加过量 .这就出现了多余的钡离子了.1年前查看全部
- 已知由海水制得的粗盐中含有的主要成分为氯化钠,还有不溶性泥沙,可溶性氯化钙,氯化镁以及硫酸盐,设计实验提纯氯化纳
 yqbtb8131年前1
yqbtb8131年前1 -
 苗玉 共回答了20个问题
苗玉 共回答了20个问题 |采纳率95%这到题目我读书的的时候化学书上有,建议你仔细看看一下书1年前查看全部
- 为什么粗盐提纯蒸发步骤中,不能用酒精灯加热至滤液蒸干,再停止加热.而是待蒸发皿中有较多晶体就停止...
为什么粗盐提纯蒸发步骤中,不能用酒精灯加热至滤液蒸干,再停止加热.而是待蒸发皿中有较多晶体就停止...
为什么粗盐提纯蒸发步骤中,不能用酒精灯加热至滤液蒸干,再停止加热.而是待蒸发皿中有较多晶体就停止加热?还有:醋酸和甲醇的化学式怎么写? 雨baby1年前1
雨baby1年前1 -
 千禧成狼d 共回答了20个问题
千禧成狼d 共回答了20个问题 |采纳率95%当彻底加热至滤液蒸干时,蒸发皿还是热的这样会容易破碎,如果加热至晶体出现时,再用蒸发皿的余热就可以是其中的水分蒸干.1年前查看全部
- 已知20摄氏度时,NaCl的溶解度为40g/100g水,试通过计算说明粗盐提纯实验中,要溶解10g粗盐,需要量取水的
已知20摄氏度时,NaCl的溶解度为40g/100g水,试通过计算说明粗盐提纯实验中,要溶解10g粗盐,需要量取水的
求需要量取水的体积为多少毫升时较为适宜 答案为30ml xsxiaopai1年前2
xsxiaopai1年前2 -
 chase4_1 共回答了14个问题
chase4_1 共回答了14个问题 |采纳率92.9%已知20摄氏度时,NaCl的溶解度为40g/100g水
即:100g(水)---------40g(氯化钠)
x 10g
100g/40g=x/10g
x=25g(25ml)1年前查看全部
- 1.在用托盘天平称量5g粗盐的过程中你认为操作错误的是( )
1.在用托盘天平称量5g粗盐的过程中你认为操作错误的是( )
A称量之前先调节天平平衡
B左边放粗盐,右边放砝码
C称量纸只用在了左盘
D托盘天平平衡时就停止称量
2.某学生做过滤试验后发现,经过过滤的液体仍有浑浊的现象,请你帮他找出造成此现象的两种可能原因
①_____________________________
②______________________________
3,.鉴别三瓶无色气体,分别是空气、二氧化碳、氧气,写出操作步骤、现象和结论
实验目的:_______
实验仪器:________
操作步骤______________
实验现象_______________
实验结论_________________
求写具体 开学考试的内容 只有二十分了…抱歉
补一道题…4.随着绿色奥运的理念逐渐深入人心,空气质量日益受到人们的关注,下列物质中,不计入每日空气质量检测的是( )
A二氧化硫 B二氧化氮 C二氧化碳 D可吸入颗粒 jrtds1年前1
jrtds1年前1 -
 gdfgtf 共回答了16个问题
gdfgtf 共回答了16个问题 |采纳率81.3%1.在用托盘天平称量5g粗盐的过程中你认为操作错误的是( C )
A称量之前先调节天平平衡
B左边放粗盐,右边放砝码
C称量纸只用在了左盘
D托盘天平平衡时就停止称量
称量纸必须两边都放.
2.某学生做过滤试验后发现,经过过滤的液体仍有浑浊的现象,请你帮他找出造成此现象的两种可能原因
①玻璃棒靠在了只有一层滤纸的一端
②滤纸有破损
3,.鉴别三瓶无色气体,分别是空气、二氧化碳、氧气,写出操作步骤、现象和结论
实验目的:鉴别上述气体
实验仪器:集气瓶,带火星的木棒
实验步骤:
操作步骤:将三个带火星的木棒分别插入三瓶气体中,观察现象.
实验现象:在氧气中的木棒发出更亮的光;在空气中的木棒没有变化;在二氧化碳中的木棒熄灭
实验结论:鉴别出了三瓶无色气体
4.随着绿色奥运的理念逐渐深入人心,空气质量日益受到人们的关注,下列物质中,不计入每日空气质量检测的是( C )
A二氧化硫 B二氧化氮 C二氧化碳 D可吸入颗粒1年前查看全部
- 食盐涨价了吗?颗粒盐(也就是粗盐)能长期食用吗?能代替精制盐吗?
食盐涨价了吗?颗粒盐(也就是粗盐)能长期食用吗?能代替精制盐吗?
昨天去买盐的时候,发现以前买1元钱/包的中盐,现在要1元4角了,怎么涨了这么多? wang92081年前2
wang92081年前2 -
 九雁 共回答了26个问题
九雁 共回答了26个问题 |采纳率88.5%盐一般不会轻易涨价的,粗盐不能长期食用,里面不含有碘,不能代替精盐,如果该地区不缺碘的话,可以交替食用.1年前查看全部
- 初中除去粗盐中的氯化钙方程式
 ROOM5011年前3
ROOM5011年前3 -
 谁语如诉 共回答了19个问题
谁语如诉 共回答了19个问题 |采纳率84.2%Na2CO3 + CaCl2===CaCO3 + 2NaCl 碳酸钙沉淀1年前查看全部
- ★粗盐提纯★实验报告★名称 目的(?) 器材 现象(真奇怪 这个有吗) 结论(?)问题与讨论(问题为“提纯后的粗盐就是纯
★粗盐提纯★实验报告★
名称 目的(?) 器材 现象(真奇怪 这个有吗) 结论(?)问题与讨论(问题为“提纯后的粗盐就是纯净的NaCl吗 还有什么成分 如何除杂质”)
关键是 目的 现象 结论 jason99581年前2
jason99581年前2 -
 早z在wi 共回答了22个问题
早z在wi 共回答了22个问题 |采纳率95.5%一、实验目的
1.掌握溶解、过滤、蒸发等实验的操作技能.
2.理解过滤法分离混合物的化学原理.
3.体会过滤的原理在生活生产等社会实际中的应用.
二、实验仪器和药品
药品:粗盐,水
器材:托盘天平,量筒,烧杯,玻璃棒,药匙,漏斗,铁架台(带铁圈),蒸发皿,酒精灯,坩埚钳,胶头滴管,
滤纸,剪刀,火柴,纸片
三、实验原理
粗盐中含有泥沙等不溶性杂质,以及可溶性杂质如: 等.不溶性杂质可以用溶解、过滤的方法
除去,然后蒸发水分得到较纯净的精盐.
四、实验操作
1.溶解
用托盘天平称取5克粗盐(精确到0.1克).用量筒量取10毫升水倒入烧杯里.用药匙取一匙粗盐加入水中,观察发生的现象.用玻璃棒搅拌,并观察发生的现象(玻璃棒的搅拌对粗盐的溶解起什么作用?).接着再加入粗盐,边加边用玻璃棒搅拌,一直加到粗盐不再溶解时为止.观察溶液是否浑浊.
在天平上称量剩下的粗盐,计算在10毫升水中大约溶解了多少克粗盐.
2.过滤
按照化学实验基本操作6所述方法进行过滤.仔细观察滤纸上的剩余物及滤液的颜色.滤液仍浑浊时,应该再过滤一次.
如果经两次过滤滤液仍浑浊,则应检查实验装置并分析原因,例如,滤纸破损,过滤时漏斗里的液面高于滤纸边缘,仪器不
干净等.找出原因后,要重新操作.
3.蒸发
把得到的澄清滤液倒入蒸发皿.把蒸发皿放在铁架台的铁圈上,用酒精灯加热(图20).同时用玻璃棒不断搅拌滤液.
等到蒸发皿中出现较多量固体时,停止加热.利用蒸发皿的余热使滤液蒸干.
4.用玻璃棒把固体转移到纸上,称量后,回收到教师指定的容器.比较提纯前后食盐的状态并计算精盐的产率.
五、实验总结
过滤操作中的问题探析
过滤是最常用的分离液体和固体的实验操作.现行的初中化学教材中仅粗浅地介绍了过滤的操作要点,而实际操作过程中,往往会遇到许多细节性的问题.笔者结合教学实际,就过滤操作中经常遇到的问题谈一下自已的解决办法,仅供参考.
(一)、怎样选择漏斗和滤纸?
漏斗的大小主要取决于要过滤的沉淀的量或析出固体的量,而不是看液体的体积.沉淀量或固体量较多,则所选用的漏斗就大,反之亦然.漏斗的圆锥角应为60°.管径粗细适宜,太粗难以保持水柱,太细则水流速度慢,过滤需要的时间过长.管径末端应稍微倾斜.滤纸的选择依据所做的实验来定.滤纸分定性滤纸和定量滤纸.定性滤纸在过滤操作中主要用于研究物质的物理性质和化学性质;定量滤纸主要用于物质的定量分析.在中学实验中,过滤操作常用于定性实验,所以大多用定性滤纸.选好的滤纸放入漏斗后,纸的边缘要比漏斗边缘低5毫米左右为宜.
(二)、怎样组装过滤器?
首先,将选好的滤纸对折两次,第二次对折要与第一次对折的折缝不完全重合.当这样的滤纸放入漏斗(顶角60°)中,其尖角与漏斗壁间有一定的间隙,但其上部却能完好贴在漏斗壁上.这样装成的过滤器比所有表面都贴在漏斗上的过滤器的过滤速度更快.对折时,不要把滤纸顶角的折缝压得过扁,以免削弱尖端的强度.然后剪去三层纸那边的两层的小角,以便在湿润后,滤纸的上部能紧密地贴在漏斗壁上.
其次,将叠好的滤纸放入合适的漏斗中,用洗瓶的水湿润滤纸,用手指把滤纸上部1/3处轻轻压紧在漏斗壁上.把水注入漏斗时,漏斗颈应充满水,或用手指堵住漏斗颈末端,使其充水至漏斗顶角稍上部为止.漏斗颈保持有连续的水柱,会产生向下的引力,加速了过滤过程.
(三)、怎样正确地进行过滤?
在过滤时,玻璃棒与盛有过滤液的烧杯嘴部相对着;玻璃棒末端和漏斗中滤纸的三层部分相接近,但不能触及滤纸;要保持垂直(笔者认为玻璃棒斜立易导致过滤液外溢);漏斗的颈部尖端紧靠接收滤液烧杯嘴部的内壁.每次转移的液体不可超过滤纸高度的三分之二,防止滤液不通过滤纸而由壁间流出.对于残留在烧杯里的液体和固体物质应该用溶剂或蒸馏水按少量多次的原则进行润冲,将洗液全部转移到漏斗中进行过滤.
(四)、怎样正确洗涤沉淀物?
如果需要洗涤沉淀物,则应立即进行洗涤,否则沉淀物在滤纸上放置过久会开裂或结块,不易润洗.可用原溶剂、蒸馏水或其它适当的洗涤剂进行润洗.换一个洁净的空烧杯以代替原来接受滤液的烧杯,这样可以避免因沉淀穿透滤纸而要重新过滤大体积的液体.每次洗液用量以能浸没所收集的沉淀物为宜.洗涤时,用少量洗液小心沿四周从上而下冲洗,将沉淀冲到漏斗底部,不可使液体流速过猛,否则会使沉淀冲出过滤器.也不可用玻璃棒搅拌漏斗内的物质,以免划破滤纸,前功尽弃.一般洗2到3次左右,可基本洗净
(五)、怎样检验沉淀物是否洗净?
可根据沉淀物上可能检出的杂质类别,在最后一次洗出液中加入适宜的试剂,来检验洗涤程度.如过滤Na2SO4、BaCl2两溶液恰好完全反应后的混合物时,要检验沉淀物是否洗净,应选择AgNO3溶液.若在最后一次洗出液中加入AgNO3溶液无沉淀(AgCl)生成,则说明沉淀已洗净.
(六)、过滤时,滤液过多而超出滤纸边缘或滤纸被划破怎么办?
可用少量原溶剂冲洗漏斗和滤纸2到3次,原滤液连同洗液重新进行过滤.
(七)、分离沉淀和液体是否必需用过滤操作?
否.当分离的沉淀量很少时,可盛物于离心试管内,用离心机进行常温下沉淀分离.用吸管吸取沉淀上清液.根据需要可进行洗涤后再离心分离.只有当沉淀量较多时,才适宜用过滤法分离
(八)、过滤操作是否还有其他方式?
有.要使过滤速度快,且方便洗涤,可用布氏漏斗进行减压抽滤,这使得过滤和洗涤费时少,而且便于洗涤;当过滤需要在一定温度下进行时应选用保温漏斗进行过滤.1年前查看全部
大家在问
- 1空气中氮气和氧气的体积比为1比4,多少升空气中含有6升氧气?已知在标准状态下,空气的密度为1.293g/L,这些空气的质
- 2实验室用Cu与浓HNO3在常温下反应制取NO2气体,同时生成Cu(NO3)2和H2O,试回答:
- 3炎热的夏天把湿衣服挂到窗外,经风一吹很快就干了;在冬天把湿衣服挂在室内干得很慢.决定衣服干得快慢的主要因素是:_____
- 41k平方米等于多少平方米
- 5绝对值大于三而不大于6的所有负整数之和为_____
- 6修改病句。(1)小鸟对着灯火唱起了去年唱过的歌声。___________________________________
- 7关于李时珍跋山涉水而编了本草纲目用什么诗句形容
- 8为五种标点符号,各写一份年龄、性别、和性格的
- 912乘14等于168,把两个因数都扩大到原来的5倍,积变成
- 10圆A:x2+y2+4x+2y+1=0与圆B:x2+y2-2x-6y+1=0的位置关系是( )
- 11a,b,5a,7,3b,……c成等差数列,a+b+5a+7+3b+……+c=2500,则a,b,c,的值为
- 12右图为电解水的简易装置,下列叙述不正确的是 A.该实验说明水是由氢,氧两种元素组成的 B.该实验说
- 13花开之季,人生悟 作文
- 14(2011•富源县模拟)一个集邮爱好者买了2元和5元的邮票共34张,正好用了98元.这两种邮票各多少张?
- 15给家长写一封“新春祝福”信1.要表达感恩之情、理解之情、敬意和祝福2.不能抄袭3.要写得所有人都能用,不能有什么发生的事
