7 分)(1)锌片长期暴露在空气中表面会形成一层薄膜,其主要成分是碱式碳酸锌【Zn 2 (OH) 2 CO 3 】。若该
 sxllsw2022-10-04 11:39:541条回答
sxllsw2022-10-04 11:39:541条回答| 7 分)(1)锌片长期暴露在空气中表面会形成一层薄膜,其主要成分是碱式碳酸锌【Zn 2 (OH) 2 CO 3 】。若该物质通过化合反应生成,反应物除 Zn 外,还有 ①N 2 ②O 2 ③CO 2 ④H 2 O中的()
①反应中产生的气体的质量是 g。 ②计算该废液中硫酸的质量分数(写出计算过程,计算结果保留一位小数)。 ③如果铁钉的铁锈未除净,对硫酸的质量分数的计算结果的影响是“偏大”“偏小”、 无影响”),理由是 。 |

已提交,审核后显示!提交回复
共1条回复
 jessica8513 共回答了17个问题
jessica8513 共回答了17个问题 |采纳率94.1%- (1)C(1分) (2)①0.1(1分)②32.7%;③偏小(1 分);硫酸与铁锈反应(1 分)
- 1年前
相关推荐
- 在100g稀硫酸中放入一小块锌片,待反应停止,称得溶液的质量为106.3g
在100g稀硫酸中放入一小块锌片,待反应停止,称得溶液的质量为106.3g
1)有多少克锌参加了反应?
2)生成氢气的质量是多少? lzlxl1231年前1
lzlxl1231年前1 -
 liangxianchun 共回答了22个问题
liangxianchun 共回答了22个问题 |采纳率90.9%用差量法计算.
Zn+H2SO4=ZnSO4+H2↑ △m
98 161 63(161-98)
溶液增加的质量是106.3-100=6.3g
设参加反应Zn的质量是x,生成H2的质量是y.
Zn+H2SO4=ZnSO4+H2↑ △m
65 2 63
x y 6.3g
65/x=2/y=63/6.3
x=6.5g
y=0.2g
答:(1)有6.5g锌参加了反应.
(2)生成氢气的质量是0.2g.1年前查看全部
- 把锌片放入下列物质的溶液中,溶液的质量增加且无气体产生的是( )
把锌片放入下列物质的溶液中,溶液的质量增加且无气体产生的是( )
A. 硫酸铜
B. 硫酸镁
C. 硫酸
D. 硝酸银 gzwilliam1年前1
gzwilliam1年前1 -
 fk6o 共回答了26个问题
fk6o 共回答了26个问题 |采纳率76.9%解题思路:利用差量法,把溶液作为一个整体,分析影响溶液质量的量有哪些,再根据金属活动性顺序及各物质发生化学反应时的质量关系来分析解答.在金属活动性顺序表中,氢前面的金属能和常见的酸发生置换反应,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来.A、把锌片放入硫酸铜溶液中,锌能把铜置换出来,由反应时的质量关系可知,每65份质量的锌可置换出63.5份质量的铜,因此溶液的质量会增加,故A符合题意;B、由于镁的活动性要比锌更强,所以把锌片放入硫酸镁溶液中不...
点评:
本题考点: 金属的化学性质;质量守恒定律及其应用.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义并结合反应前后物质的质量关系进行.1年前查看全部
- 用导线将锌片无铁片相连,浸入氯化锌溶液中,可以做原电池吗
 yangcong64061年前1
yangcong64061年前1 -
 tt的尸体 共回答了18个问题
tt的尸体 共回答了18个问题 |采纳率88.9%理论上可以,因为这已经构成了原电池.
但实际上,其电动势很小,电流极微弱,没有实际意义.
只有那些有明显氧化还原反应的才会有较强的电流.比如铜锌稀硫酸原电池.1年前查看全部
- 关于是否同时发生置换反应实验把锌片和铁片同时投到足量的硫酸铜中,那个会先把铜置换出来,还是同时置换出铜来?前提是足量的硫
关于是否同时发生置换反应实验
把锌片和铁片同时投到足量的硫酸铜中,那个会先把铜置换出来,还是同时置换出铜来?
前提是足量的硫酸铜啊,
为什么做实验得到的结果是同时反应捏,
实验:取硫酸铜溶液到大试管的二分之一,把锌片投入试管底部,把铁片悬挂在溶液上部分,
结果是都置换出了黑色的铜粉.
可是铁也有置换出铜啊,那么怎么就不是同时反应了捏. shangyi2003121年前1
shangyi2003121年前1 -
 爱谁谁_kk 共回答了6个问题
爱谁谁_kk 共回答了6个问题 |采纳率100%实际上是同时置换的
化学反映其实都是一个动态的.只不过高中为了学习方便才那样说的
就算硫酸铜不是足量的,也会同时反映
而且最终溶液里面还会有铜离子和亚铁离子,只不过量少而已1年前查看全部
- 电解质与水反应习题下列物质混合发生化学反应,且属于离子反应的是A、NaOH溶液和K2SO4溶液混合B、锌片投入稀硫酸中C
电解质与水反应习题
下列物质混合发生化学反应,且属于离子反应的是
A、NaOH溶液和K2SO4溶液混合
B、锌片投入稀硫酸中
C、KClO3和MnO2固体混合物加热制O2
D、H2和O2反应生成水 jimyytao1年前4
jimyytao1年前4 -
 hyacinth_gg 共回答了16个问题
hyacinth_gg 共回答了16个问题 |采纳率93.8%当物质是离子化合物,且在溶液或熔融状态下同其他物质发生反应可以属于离子反应.当物质是共价化合物,且在溶液中同其他物质反应可以属于离子反应.
这样,A、NaOH和K2SO4两种物质不能反应,在混合溶液中只能共存.
B、Zn在稀硫酸中和H2SO4店里出的H+反应生成氢气,属于离子反应.
C、由于这两种物质是固体状态,无法电离出离子,因此该反应是物质分子的反应.
D、H2和O2经点燃生成水,两种物质同样是分子状态,因此该反应是物质分子的反应.
所以,选择B.1年前查看全部
- 化学题一道,会的快进.为了探究金属的活动性顺序,张丽同学用铁丝、锌片、铜丝、稀盐酸.硫酸铜溶液、硝酸银溶液进行以下实验.
化学题一道,会的快进.
为了探究金属的活动性顺序,张丽同学用铁丝、锌片、铜丝、稀盐酸.硫酸铜溶液、硝酸银溶液进行以下实验.
实验一:将锌片与铜片分别放入稀盐酸中,锌片表面有气泡产生,铜片无明显变化;
实验二:将铁丝放入硫酸铜溶液中,铁丝表面有红色固体沉积;
实验三:将铜片放入硝酸银溶液中,铜片表面有黑色物质生成,一段时间后逐渐变为银白色.
(1)由以上实验可以得出金属活动性的关系是——;
(2)要确定上述四种金属的活动性顺序,应补充——实验,理由是——. candy铃子1年前6
candy铃子1年前6 -
 sheday1 共回答了18个问题
sheday1 共回答了18个问题 |采纳率100%(1)实验一:金属活动性Zn大于Cu
实验二:金属活动性Fe大于Cu
实验三:金属活动性Cu大于Ag
由以上实验可以得出金属活动性的关系是Zn大于Cu Fe大于Cu Cu大于Ag
(2)将锌片放入硫酸亚铁溶液中.理由是上述实验无法比较Zn和Fe的金属活动性强弱1年前查看全部
- 把锌片放入下列液体中反应,液体的质量
 清晨雾语1年前2
清晨雾语1年前2 -
 有心人世间 共回答了15个问题
有心人世间 共回答了15个问题 |采纳率86.7%65g锌置换出216g的银
即:有65g锌进入了溶液,216g银析出了溶液
溶液质量减少:216g-65g=151g
切记:没有溶于水的部分不属于溶液
不懂追问~1年前查看全部
- 将锌片和铜片用导线连接置于同一稀硫酸溶液中,下列各叙述正确的是
将锌片和铜片用导线连接置于同一稀硫酸溶液中,下列各叙述正确的是
a.正极附近so42-的浓度逐渐增大 b.负极附近so42-的浓度逐渐减小
c.负极附近so42-的浓度逐渐增大 d.正负极附近so42-的浓度基本不变
我知道so42-的浓度在溶液中是不变的,但为什么正负极附近so42-的浓度基本不变.
so42-不是会有向负极移动的趋势吗?为什么它正极的离子浓度还保持不变? maabbcck1年前3
maabbcck1年前3 -
 wlll2d 共回答了15个问题
wlll2d 共回答了15个问题 |采纳率100%反应的主要是锌片和溶液中的H+反应,而SO42-只是一个导电介质不参加反应且在反应时间内溶液中的离子分部大致不会变化
你的题目还有点歧义1年前查看全部
- 在盛有稀H 2 SO 4 的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是 [
在盛有稀H 2 SO 4 的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是 [ ]A.正极附近的SO 4 2- 离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O 2 逸出
D.铜片上有H 2 逸出 水墨蝶尘1年前1
水墨蝶尘1年前1 -
 夜空的月亮 共回答了16个问题
夜空的月亮 共回答了16个问题 |采纳率81.3%D1年前查看全部
- (2007•济宁)为探究金属的活动性顺序,张丽同学利用铁丝、锌片、铜丝、稀盐酸、硫酸铜溶液、硝酸银溶液进行了下面的实验:
(2007•济宁)为探究金属的活动性顺序,张丽同学利用铁丝、锌片、铜丝、稀盐酸、硫酸铜溶液、硝酸银溶液进行了下面的实验:
实验一:将锌片与铜片分别放入稀盐酸中,锌片表面有气泡产生,铜片无明显变化;
实验二:将铁丝放入硫酸铜溶液中,铁丝表面有红色固体沉积;
实验三:将铜片放入硝酸银溶液中,铜片表面有黑色物质生成,一段时间后逐渐变为银白色.
(1)由实验可得出的金属活动性关系是______;
(2)要确定上述四种金属的活动性顺序,应补充______实验,理由是______. c54531d4d01060f41年前1
c54531d4d01060f41年前1 -
 qjx0816 共回答了16个问题
qjx0816 共回答了16个问题 |采纳率75%解题思路:分析探究实验所出现的实验现象,判断四种金属的活动性强弱关系;并对实验方案中的不足进行修改和完善.(1)由实验一的现象可得知,锌在活动性顺序表中处于H之前而铜处于H之后;由实验二的现象可知,金属铁的活动性比铜强;由实验三的现象可知,金属铜的活动性比银强;
故答案为:锌、铁>铜>银(或Zn、Fe>Cu>Ag);
(2)由探究方案中的三个实验的分析,可发现金属锌与铁的活动性强弱关系尚未明确,因此需要补充检验两金属活动性强弱的实验;可利用两金属与酸反应比反应速率或利用两金属间的置换来检验;
故答案为:锌、铁与稀盐酸(稀HCl)【或锌与硫酸亚铁(FeSO4)溶液】;通过比较二者的反应速率,确定锌与铁的活动性顺序[或锌是否可以置换出硫酸亚铁溶液中的铁,确定锌与铁的活动性顺序)说明(2)小题中,其他合理答案也可得分.]点评:
本题考点: 金属活动性的探究.
考点点评: 根据金属与酸反应看反应速率,或金属与盐溶液反应看结果的方法,比较金属的活动性.1年前查看全部
- 实验题:现有药品:W g(W<1)锌片、稀硫酸、无水硫酸铜、氧化铜和水。请从图中选用适当的实验装置,设计一个简单的
实验题:现有药品:W g(W<1)锌片、稀硫酸、无水硫酸铜、氧化铜和水。请从图中选用适当的实验装置,设计一个简单的实验,粗略测定锌的相对原子质量(假设环境为标准状况)。
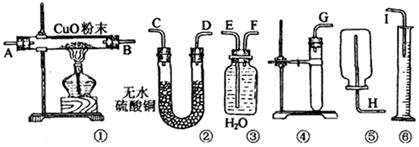
(1)应选用的装置是(只要求写出图中装置的标号) 。
(2)所用装置的连接顺序是(填各接口的字母,胶管省略) 。
(3)为了保证不漏出氢气,操作中加放试剂 的方法是 。
的方法是 。
(4)用实验所测得的数据,写出计算锌的相对原子质量的数学式:Mr(Zn)= 。 lemonsj1年前1
lemonsj1年前1 -
 江西人咋了 共回答了21个问题
江西人咋了 共回答了21个问题 |采纳率90.5%(1)③④⑥
(2)J接 F E接 I
(3)向试管中加入足量稀硫酸后,将试管斜放,再把锌片放在试管内壁上,塞紧塞子,慢慢直立,使锌滑下,与稀硫酸接触。
(4)22.4W/V(H 2 )
略1年前查看全部
- 将锌片和铜片用导线连接后放入硫酸铜溶液中,发生原电池反应(反应前后溶液体积不变),在反应过程中,下列叙述错误的是 A.电
将锌片和铜片用导线连接后放入硫酸铜溶液中,发生原电池反应(反应前后溶液体积不变),在反应过程中,下列叙述错误的是
A.电子由锌片经导线流向铜片 B.铜片作正极,锌片作负极 C.溶液中SO 4 2 - 的物质的量浓度保持不变 D.溶液中Cu 2+ 移向负极  我是小白谁不怕1年前1
我是小白谁不怕1年前1 -
 逆风刀刃 共回答了13个问题
逆风刀刃 共回答了13个问题 |采纳率100%D
1年前查看全部
- 有一块锌片插入足量CuSO4溶液中,锌片质量减轻了0.1g
有一块锌片插入足量CuSO4溶液中,锌片质量减轻了0.1g
(1)参加反应的Zn的物质的量
(2)析出铜的量
(3)生成ZnSO4的物质的量及质量
(4)溶液的质量是增加还是减少
问:既然是锌片质量减轻了0.1g,为什么不是反应了0.1g锌,而要铜x-0. 裙下之臣1年前1
裙下之臣1年前1 -
 cici配 共回答了16个问题
cici配 共回答了16个问题 |采纳率93.8%因为反应 Zn+ CuSO4= ZnSO4 +Cu 从反应来看进去了锌,出来了铜,而锌比铜重,所以减轻,
减轻的不是锌的质量,而是 锌和铜的质量差1年前查看全部
- 将锌片放入下列溶液中过一段时间后溶液的质量减小的是 A,AgNO3 b,H2SO4 C,NaCl d,HCl
 qzy27181年前1
qzy27181年前1 -
 www_job1688_com 共回答了15个问题
www_job1688_com 共回答了15个问题 |采纳率93.3%A 2 AgNO3 +zn =2 Ag+Zn(no3)2
65 216 进去 65出来216 溶液的质量减小1年前查看全部
- :一块表面被氧化的锌片跟100g溶质的质量分数为19.6%的稀H2SO4恰好完全反应,生成0.2g H2,求:
:一块表面被氧化的锌片跟100g溶质的质量分数为19.6%的稀H2SO4恰好完全反应,生成0.2g H2,求:
(1)、锌片中被氧化的锌元素的质量
(2)、反应后溶液中溶质的质量分数 琴麻岛的相当左161年前1
琴麻岛的相当左161年前1 -
 温馨X 共回答了15个问题
温馨X 共回答了15个问题 |采纳率86.7%设未氧化的锌质量为xg,被氧化的为yg,则ZnO质量为81y/65g,则
Zn+H2SO4=ZnSO4+H2 ZnO+H2SO4=ZnSO4+H2O
65g 98g 161g 2g 81g 98g 161g
x=6.5g 9.8g 16.1g 0.2g 81y/65 19.6—9.8g 16.1g
(19.6g=100g*19.6%)
y=6.5g
所以,反应后m(ZnSO4)=32.2g,溶液质量为100g+6.5g+8.1g—0.2g=114.4g,
溶质的质量分数=32.2g/114.4g=?自己算
答:锌片中被氧化的锌元素的质量为6.5g,溶质的质量分数=32.2g/114.4g=?自己算.1年前查看全部
- 在铜锌电解池中,(电解质溶液为硫酸铜溶液,阳极为锌片,阴极为铜片),
在铜锌电解池中,(电解质溶液为硫酸铜溶液,阳极为锌片,阴极为铜片),
在铜锌电解池中(电解质溶液为硫酸铜溶液,阳极为锌片,阴极为铜片),
1.为什么锌片会自己自动失去电子,然后锌原子变成锌离子?硫酸铜溶液为什么不和锌片直接发生氧化还原反应,即锌原子直接把电子转移给铜离子?
2.锌离子出来后为什么不会趋向阴极(铜片),然后又得到电子变成锌原子,形成单质锌?
打错了 是原电池 不是电解池 青帮小老大1年前3
青帮小老大1年前3 -
 凤翅镏金 共回答了12个问题
凤翅镏金 共回答了12个问题 |采纳率100%电解池问题 (请耐心看完)
1电解池由阴极 阳极 电解液体构成 已经形成了闭合的回路 所以回有电子的流动 通常是活泼的金属失电子
因为锌是做负极 负极失电子 阳极得电子(怎样判断阴阳级?通常 相对活泼的金属是做阴极的 锌比铜活泼所以 锌是负)
硫酸铜可以和锌片反应的 因为锌比铜活泼 可以置换铜 不知道你为什么说不能反应
2 这就要看溶液里有什么离子了上述溶液里正离子有氢离子与锌离子 这也涉及了离子的放电顺序 氢离子 》锌离子
也就是说 氢离子的氧化性强于锌离子 氢离子比锌离子先得到电子 所以不会析出单质锌 只会析出氢气
够详细了吧1年前查看全部
- 在一个电路中,有电源\电压表\导线和小灯泡.现在用铜片和锌片测小灯泡的电压,请问铜片是正极还是锌片是正极
 一剑7101年前1
一剑7101年前1 -
 牛股889 共回答了15个问题
牛股889 共回答了15个问题 |采纳率100%灯泡电压?一般来说铜是正极,但题有问题吧,不顺眼.1年前查看全部
- 原电池导电的电量如何算如将锌片和铜片浸入稀盐酸中组成原电池,总质量为60g,一段时间后总质量为47g问:通过导线的导电量
 hongqi3751年前1
hongqi3751年前1 -
 日光下的月光 共回答了13个问题
日光下的月光 共回答了13个问题 |采纳率92.3%电量Q=n*NA*q
n 为电子的物质的量
NA 阿伏加德罗常数
q 每个电子的电量1.60*10^-19C (库伦)1年前查看全部
- 在盛有稀硫酸的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是()
在盛有稀硫酸的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是()
A 正极附近的硫酸根离子浓度逐渐增大
B电子通过导线由铜片流向锌片
C正极有氧气逸出
D铜片上又氢气逸出
为什么A错呢,正极附近氢离子得电子生成氢气,那么硫酸根离子不增多吗 ed4j7gei1年前5
ed4j7gei1年前5 -
 读个本科有aa 共回答了23个问题
读个本科有aa 共回答了23个问题 |采纳率95.7%选D
正极附近的硫酸根浓度应该减少.你可以这样考虑负极失电子.生成了锌离子在负极周围的负电荷就少了,需要硫酸根去补充,保持电中性.而正极得到电子生成氢气,正电荷减少,硫酸根也就减少了.你的理解错误在在硫酸根稀溶液中硫酸不是以H2SO4的形式存在,而是以硫酸根和氢离子的形式存在.希望我的回答对你有帮助1年前查看全部
- 下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是( )
下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是( )
A. 10℃3mol/L的盐酸溶液
B. 20℃2mol/L的盐酸溶液
C. 10℃4mol/L的盐酸溶液
D. 20℃4mol/L的盐酸溶液 zy8281年前5
zy8281年前5 -
 Riki_玻璃nn 共回答了14个问题
Riki_玻璃nn 共回答了14个问题 |采纳率100%解题思路:影响化学反应速率的因素:温度越高反应速率越快,浓度越大,反应速率越快.根影响化学反应速率的因素:温度越高反应速率越快,所以A、C的最慢;浓度越大,反应速率越快,所以D最快.
故选D.点评:
本题考点: 化学反应速率的影响因素.
考点点评: 本题较简单,考查影响化学反应速率的常见因素,可以根据所学知识进行回答,较简单.1年前查看全部
- 在盛有稀硫酸的烧杯中放入导线连接的锌片和铜片,下列叙述正确的是( )
在盛有稀硫酸的烧杯中放入导线连接的锌片和铜片,下列叙述正确的是( )
A.正极有O2逸出
B.铜片上有H2逸出
C.正极附近的SO42-离子浓度逐渐增大
D.电子通过导线由铜片流向锌片 樱冢昴流1年前1
樱冢昴流1年前1 -
 学着做vv 共回答了17个问题
学着做vv 共回答了17个问题 |采纳率100%解题思路:该原电池中,较活泼的金属锌作负极,负极上锌失电子发生氧化反应;铜作正极,正极上氢离子得电子发生还原反应生成氢气;电子从负极沿导线流向正极;溶液中阴离子向负极移动,阳离子向正极移动,据此分析.A、正极上氢离子得电子生成氢气,有H2逸出故A错误;
B、铜片作正极,正极上氢离子得电子生成氢气,故B正确;
C、原电池放电时,溶液中阴离子向负极移动,所以阴极附近的SO42-浓度逐渐增大,故C错误;
D、原电池放电时,电子从负极沿导线流向正极,即电子通过导线由锌片流向铜片,故D错误.
故选B.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理,难度不大,难点是判断溶液中阴阳离子的移动方向,很多学生认为阴离子向正极移动,阳离子向负极移动.1年前查看全部
- 锌片与铜离子直接接触发生反应而影响原电池的放电效率,为什么影响,加上盐桥就不影响了?主要求解第一句!
 bobo飘特飘1年前2
bobo飘特飘1年前2 -
 yaqipei758 共回答了19个问题
yaqipei758 共回答了19个问题 |采纳率89.5%主要是电解质也有部分原因,比如你问的cu跟zn,在硝酸中,虽然说zn活泼,失电子,但是cu也会有一小部分跟硝酸反应,就会使放电效率有变化.而用了盐桥,cu所在电解质不是硝酸了,为硝酸铜,所以就避免了这个问题1年前查看全部
- 某同学将一锌片投入10g 稀硫酸中,待锌片完全消失后,称得溶液的质量为11.2g,求投入的锌片质量为多少g?
某同学将一锌片投入10g 稀硫酸中,待锌片完全消失后,称得溶液的质量为11.2g,求投入的锌片质量为多少g?
2.在做电解水的实验时,常在水中加入少量硫酸以增强水的导电性,现用125g 8%的硫酸进行电解水的实验,一段时间后测得溶液中硫酸的质量分数为20%,求已分解的水的质量。 1254857011年前1
1254857011年前1 -
 白狼19822002 共回答了18个问题
白狼19822002 共回答了18个问题 |采纳率88.9%1、Zn:26/21g≈1.24g 设 Zn的质量为X,稀硫酸的质量分数为A.根据化学方程式可得X=325A/49 H2质量为10A/49 根据质量守恒可得X+10g-10A/49=11.2g ∵X=325A/49 ∴
325A/49+10g-10A/49=11.2g ∴A=14/75 把A=14/75代入X=325A/49 得X=26/21g
2、 H2O:75g 根据溶质质量=溶液质量*溶液质量分数可得硫酸质量为125g*8%=10g ∴溶剂质量(水)为溶液质量-溶质质量=125g-10g=115g 又∵溶液质量’=溶质质量/溶液质量分数’=10g/20%=50g ∴溶剂质量(水’)为溶液质量’-溶质质量=50g-10g=40g ∴已分解的水的质量=水-水’=115g-40g=75g
大致是这样1年前查看全部
- 将锌片投入下列盐溶液中,充分反应后,使溶液质量减轻的是( )
将锌片投入下列盐溶液中,充分反应后,使溶液质量减轻的是( )
A. MgCl2
B. CuCl2
C. AgNO3
D. KCl shun2821年前1
shun2821年前1 -
 上好家037 共回答了25个问题
上好家037 共回答了25个问题 |采纳率96%解题思路:锌片放入某溶液中反应一段时间后,取出洗净、干燥、称重、结果质量减轻;那就一定发生了化学反应,再根据金属活动顺序,判断和哪些溶液能发生置换反应,最后根据原子量的大小关系,判断出锌片取出之后质量是增加还是减少.A、锌的金属活动性比镁弱,所以锌不能置换出氯化镁中的镁,因此两者不会反应,故溶液质量不会改变;
B、锌的金属活动性比铜强,所以锌与CuCl2反应置换出单质铜,且每反应一个锌原子则置换出一个铜原子,锌的相对原子质量大于铜的相对原子质量,故锌片的质量减少,溶液质量变大;
C、锌的金属活动性比银强,所以锌能与硝酸银反应置换出银,且每反应一个锌原子则置换出两个银原子,置换出的银的质量大于锌,故溶液质量减轻;
D、锌的金属活动性比钾弱,所以锌与氯化钾不反应,故锌的质量溶液质量均不会变化;
故选C点评:
本题考点: 金属的化学性质.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义并结合反应前后物质的质量关系进行分析解决即可.1年前查看全部
- 将锌片和铜片用导线连接后放入稀硫酸溶液中,发生原电池反应,下列叙述错误的是( )
将锌片和铜片用导线连接后放入稀硫酸溶液中,发生原电池反应,下列叙述错误的是( )
A. 溶液的PH增大
B. 溶液中的Zn2+浓度增大
C. 溶液中的SO42-浓度增大
D. 溶液的密度增大 流浪天空下1年前6
流浪天空下1年前6 -
 季飞 共回答了24个问题
季飞 共回答了24个问题 |采纳率91.7%解题思路:锌片-铜片-稀硫酸溶液组成的原电池中,较活泼的金属锌作负极,铜作正极;负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应.A、原电池放电时,正极上氢离子得电子生成氢气析出,导致溶液中氢离子浓度降低,PH值增大,故A正确;
B、原电池放电时,负极上锌失电子生成锌离子进入溶液,导致溶液中锌离子浓度增大,故B正确;
C、原电池放电时,负极上锌失电子生成锌离子进入溶液,正极上氢离子得电子生成氢气,所以该反应中硫酸根离子浓度基本不变,故C错误;
D、原电池放电时,溶液由硫酸溶液逐渐变成硫酸锌溶液,所以溶液的密度增大,故D正确.
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理,难度不大,明确正负极上发生的电极反应是解本题的关键.1年前查看全部
- 小新用西红柿制作了一个水果电池,他用一片铜片和一片锌片制作了它的两个电极,做好该西红柿电池后,小新用电压表测量了它的电压
小新用西红柿制作了一个水果电池,他用一片铜片和一片锌片制作了它的两个电极,做好该西红柿电池后,小新用电压表测量了它的电压,你觉得它的电压有多高?( )
A. 3V
B. 220V
C. 1.5V
D. 0.2V jnbelieve1年前1
jnbelieve1年前1 -
 edmond828 共回答了21个问题
edmond828 共回答了21个问题 |采纳率100%解题思路:西红柿电池的电压应该小于干电池电压,已知一节干电池电压为1.5V,根据选项中所给电压的大小进行估测.西红柿电池提供的电压较小,应该小于一节干电池电压;而一节干电池电压为1.5V,因此西红柿电池提供的电压约0.2V.
故选D.点评:
本题考点: 电压.
考点点评: 此题考查的是水果电池提供电压的大小,水果电池提供的电压比我们常见电源提供的电压都要小,约0.2V左右.可以通过比较思想进行分析.1年前查看全部
- 锌片放入硫酸亚铁溶液中一段时间后,发现锌片表面有气泡产生为什么?
 wj338491年前2
wj338491年前2 -
 辰以 共回答了20个问题
辰以 共回答了20个问题 |采纳率85%硫酸亚铁溶液中含有一定量的硫酸,锌把铁换完了就跟硫酸反应了.1年前查看全部
- 某同学用溶质的质量分数为16%的硫酸溶液做了一个测定锌片纯度的实验(锌片中的杂质不与硫酸反应).已知硫酸溶液的密度是1.
某同学用溶质的质量分数为16%的硫酸溶液做了一个测定锌片纯度的实验(锌片中的杂质不与硫酸反应).已知硫酸溶液的密度是1.10g/立方厘米.氢气体积在相同条件下测定,氢气的密度为0.085g/L,试求锌片的纯度
编号--锌片质量/g---硫酸溶液体积/mL--生成氢气体积/L
1---------3.3-----------10-----------------0.42
2---------3.3-----------20-----------------0.84
3---------3.3-----------30-----------------1.08
4---------3.3-----------440----------------1.08
[呃..这个是"表格"
"----"只是为了让数都对着- -
具体的计算过程,] lukaijie1年前1
lukaijie1年前1 -
 XIXI777777 共回答了16个问题
XIXI777777 共回答了16个问题 |采纳率87.5%由于产生H2的质量为1.08L×0.085g/L=0.0918g
则Zn~H2
--65---2
--X----0.0918g
X=2.9835g
则其纯度为2.9835g/3.3g=90.41%1年前查看全部
- 将一块锌片插入足量硫酸铜溶液中,锌片质量减轻了0.1克.求:(1)参加反应的锌的物质的量;
将一块锌片插入足量硫酸铜溶液中,锌片质量减轻了0.1克.求:(1)参加反应的锌的物质的量;
(2)析出铜的物质的量;(3)生成硫酸锌的质量;(4)溶液的质量是增加还是减小了. nyzh12341年前3
nyzh12341年前3 -
 小小紫罗兰 共回答了18个问题
小小紫罗兰 共回答了18个问题 |采纳率88.9%Zn置换出Cu,析出的铜附着在锌片表面上,锌片不再参加反应
(1)设参加反应的锌的质量为xg.
Zn+CuSO4=ZnSO4+Cu 质量差
65 160 161 64 1
xg 0.1g
65/xg=1/0.1g x=6.5
参加反应的锌的物质的量:
xg/(65g/mol)=6.5g/(65g/mol)=0.1mol
(2)m=0.1mol*64g/mol=6.4g
(3)ZnSO4物质的量:0.1mol
(4)Zn的相对质量为65,Cu为64,相比之下溶液的质量是增加了.
☆⌒_⌒☆ 希望可以帮到you~1年前查看全部
- 锌片与铜片连接插入硫酸铜中是不是原电池?
 23gsa1年前1
23gsa1年前1 -
 songtuannian 共回答了25个问题
songtuannian 共回答了25个问题 |采纳率96%是的,锌片作负极,铜片作正极,电子通过导线从锌片流向铜片,铜离子在铜片表面被还原.1年前查看全部
- 物理课后,小南和小雄将一块铜片和一块锌片插入西红柿,做成了一个“西红柿电池”.小南和小雄想探究“西红柿电池的电压大小与哪
物理课后,小南和小雄将一块铜片和一块锌片插入西红柿,做成了一个“西红柿电池”.小南和小雄想探究“西红柿电池的电压大小与哪些因素有关”,小雄说:“可能与两金属片之间的距离有关”,小南想了想说:“也可能与两金属片插入西红柿的深度有关”. 为了验证猜想是否正确,他们找来了电压表,连成了如图所示的电路.
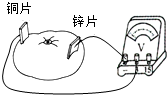
(1)请你选择其中一个猜想,并提出验证的方法.
(2)目前人们乱扔废旧电池的现象非常普遍,请你针对这种现象,给有关部门提出一条合理建议: ___ .
 nhslhm1年前1
nhslhm1年前1 -
 拉开早 共回答了15个问题
拉开早 共回答了15个问题 |采纳率80%解题思路:(1)利用控制变量法进行研究.控制金属片的深度一定,改变金属片间的距离.
控制金属片间的距离一定,改变金属片插入深度.利用电压表测量电压.
(2)电池会对环境造成污染,应回收.①猜想:“西红柿电池的电压大小可能与两金属片之间的距离有关”
步骤:
a.将一块铜片和一块锌片插入西红柿一定的深度,待电压表示数稳定后记下电压表的读数;
b.持插入西红柿的深度不变,改变铜片和锌片之间的距离,待电压表示数稳定后记下电压表的读数,重复几次;
c.比较几次电压表的读数,得出结论.
②猜想:“西红柿电池的电压大小可能与金属片插入西红柿的深度有关”
步骤:
a.将一块铜片和一块锌片插入西红柿一定的深度,待电压表示数稳定后记下电压表的读数;
b.保持铜片和锌片之间的距离不变,改变插入西红柿的深度,待电压表示数稳定后记下电压表的读数,重复几次;
c.比较几次电压表的读数,得出结论.
(2)由于电池中有电解质、重金属,乱扔废旧电池会对环境造成污染,故应分类回收.点评:
本题考点: 电压;控制变量法与探究性实验方案;能源的利用和对环境的危害.
考点点评: 本题考查了设计实验研究水果电池的电压的影响因素及对旧电池的处理,关心环境是我们每个人应有的职责.1年前查看全部
- 如图,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中分别加入等质量的锌片和铁片,则从反应开始到金属完全
如图,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中分别加入等质量的锌片和铁片,则从反应开始到金属完全反应的过程中,天平指针指向的变化是( )
 A. 始终向左偏
A. 始终向左偏
B. 始终向右偏
C. 先向左偏后向右偏
D. 先向右偏后向左偏 HAOXIANGHAOXIANG1年前1
HAOXIANGHAOXIANG1年前1 -
 dxh0414 共回答了19个问题
dxh0414 共回答了19个问题 |采纳率84.2%解题思路:根据金属与酸反应放出氢气的快慢和金属与酸反应放出氢气的多少,判断变化过程中天平指针会如何变化.天平的指针总是偏向质量大的一方;在两边的金属都没反应完时,由于锌的活动性比铁强,锌与稀盐酸反应放出氢气的速率大于铁,因此,此段时间内,加铁一边因放出氢气的速度慢而质量大,天平指针偏向加铁一边即偏向图中的右边;当金属锌完全反应后,图中天平左边的质量不再减小,而铁继续与稀盐酸反应,最终放出氢气的多少将决定天平指针的偏转,根据金属与酸反应放出氢气的质量=[金属的化合价/金属相对原子质量]×金属质量,可判断两种金属都完全反应后,铁与盐酸放出氢气的质量大于等质量的锌与盐酸反应放出氢气的质量,所以,天平左边加锌的一端因放出氢气质量少而质量大于加铁的右边,天平指针最终将偏向加锌的左边;综上所述,天平指针就先右偏后向左;
故选:D.点评:
本题考点: 金属的化学性质.
考点点评: 金属与酸反应放出氢气的快慢与金属的活动性有关,而放出氢气的多少与金属的相对质量有关.1年前查看全部
- 如图所示为铜锌原电池,下列有关说法不正确的是( ) A.锌片作负极 B.铜片上有气泡 C.电子由铜片经导线流向锌片 D
如图所示为铜锌原电池,下列有关说法不正确的是( ) A.锌片作负极 B.铜片上有气泡 C.电子由铜片经导线流向锌片 D.一段时间后,溶液中氢离子的物质的量减小 
 36634991年前1
36634991年前1 -
 余强 共回答了24个问题
余强 共回答了24个问题 |采纳率87.5%A.该装置中锌易失电子作负极,故A正确;
B.铜作正极,正极上氢离子得电子生成氢气,所以Cu上有气泡生成,故B正确;
C.电子从负极沿导线流向正极,即电子从负极锌沿导线流向正极铜,故C错误;
D.正极上氢离子得电子发生还原反应生成氢气,所以一段时间后,溶液中氢离子的物质的量减小,故D正确;
故选C.1年前查看全部
- 11、铜片、锌片连接后浸入稀H2SO4中构成原电池,当导线上通过电子3.01×1022个时,则锌失去电子________
11、铜片、锌片连接后浸入稀H2SO4中构成原电池,当导线上通过电子3.01×1022个时,则锌失去电子_________m
11、铜片、锌片连接后浸入稀H2SO4中构成原电池,当导线上通过电子3.01×1022个时,则锌失去电子_________mol,锌片质量减少_________g。铜片表面析出氢气_________L。 楚辛1年前1
楚辛1年前1 -
 诺木 共回答了22个问题
诺木 共回答了22个问题 |采纳率81.8%导线上通过电子3.01*1022个,为0.05mol,即转移电子0.05mol,锌失去0.05mol电子,Zn-2e=Zn2+,1molZn转移2mol电子,锌片质量减少65gmol-1*0.05mol/2=1.625g,电池反应为Zn+2H+=Zn2++H2(转移2e),生成H2为:22.4Lmol-1*0.05mol/2=0.56L1年前查看全部
- 质量相等的两纯净锌片,一片与稀硫酸恰好完全反应,另一片先燃烧成氧化锌后,再与上述等质量分数的稀硫酸也恰好完全反应,则下列
质量相等的两纯净锌片,一片与稀硫酸恰好完全反应,另一片先燃烧成氧化锌后,再与上述等质量分数的稀硫酸也恰好完全反应,则下列结论中正确的是( )
A 两者用去的稀硫酸质量相等
B 反应后的溶液中前者的溶质质量分数大
C 反应后两者的溶液质量相等
D 反应后的溶液中后者的溶质质量大
为什么选择A和B? 幸运传奇1年前1
幸运传奇1年前1 -
 Blazel 共回答了13个问题
Blazel 共回答了13个问题 |采纳率92.3%那是因为 Zn最后都变成了Zn离子, 1个锌都需要一个硫酸来反应,所以消耗硫酸的量是一致的. 前者跑到了氢气,后者生成了水,所以前者浓度大,也就是质量分数大1年前查看全部
- 能否用铜片,锌片和氢氧化钠溶液自制电池?
能否用铜片,锌片和氢氧化钠溶液自制电池?
效果会比氯化钠溶液好吗?还有什么好用的电解质?手头还有硫酸铜,碳酸钠和盐酸 geyinpeng1年前1
geyinpeng1年前1 -
 g1194yy3 共回答了16个问题
g1194yy3 共回答了16个问题 |采纳率75%不行,原电池必须要以自发的化学反应为基础,Zn和Cu都不能与NaOH反应,但是如果用CuSO4,HCl都可以,因为:Zn + Cu2+=== Zn2+ + Cu;Zn + 2H+===Zn2+ + H2
Na2CO3同理与Zn,Cu都不反应,所以也不行.
怎么样,有帮助吗?1年前查看全部
- (2014•浦东新区二模)图为一种铜锌原电池的示意图,A中盛ZnSO4溶液并插入锌片,B中盛CuSO4溶液并插入铜片,“
 (2014•浦东新区二模)图为一种铜锌原电池的示意图,A中盛ZnSO4溶液并插入锌片,B中盛CuSO4溶液并插入铜片,“盐桥”是一支U型管,内装用饱和KCl溶液和琼脂混合制成的胶状溶液,其作用是形成闭合回路.该原电池工作时电流计指针偏转,溶液始终保持电中性,则下列说法正确的是( )
(2014•浦东新区二模)图为一种铜锌原电池的示意图,A中盛ZnSO4溶液并插入锌片,B中盛CuSO4溶液并插入铜片,“盐桥”是一支U型管,内装用饱和KCl溶液和琼脂混合制成的胶状溶液,其作用是形成闭合回路.该原电池工作时电流计指针偏转,溶液始终保持电中性,则下列说法正确的是( )
A.导线上的电流方向为A→B
B.A中SO42-浓度有所减小
C.盐桥中Cl-向A中移动
D.B中铜片质量有所增加 cc帮女八路1年前1
cc帮女八路1年前1 -
 南极北熊 共回答了33个问题
南极北熊 共回答了33个问题 |采纳率87.9%解题思路:将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液构成的原电池中,金属锌是负极,发生氧化反应,铜是正极,发生还原反应,根据原电池的工作原理来回答.A.Zn为负极,Cu为正极,则导线上的电流方向为B→A,故A错误;B.原电池工作时,阴离子向负极移动,A中SO42-浓度基本不变,故B错误;C.原电池工作时,阴离子向负极移动,盐桥中的氯离子可向A移动,故C正确;D.Cu为...
点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查学生盐桥原电池的工作原理知识,为高频考点,侧重于学生的分析能力的考查,注意正负极的判断以及电解质中阴阳离子的移动是解题的关键,难度不大.1年前查看全部
- 书上有说明,但是我看不懂,(现以铜锌原电池为例来分析原电池的电流是怎样产生的.锌片上和ZnSO4溶液中都存在锌离子.在锌
书上有说明,但是我看不懂,(现以铜锌原电池为例来分析原电池的电流是怎样产生的.锌片上和ZnSO4溶液中都存在锌离子.在锌片和溶液的接触面上,水分子与金属表面的锌离子相互吸引,发生水合作用,使部分锌离子离开锌片进入溶液:Zn→锌离子+2电子.)就是这段话,里面一直都在说的是锌离子,为什么到最后的方程式却是锌原子变成锌离子和两个电子?我觉得可能是锌片表面的锌离子与水发生水合作用后,锌片上的锌原子变成锌离子来补充空缺的位置,
 桃桃淘气1年前3
桃桃淘气1年前3 -
 远方远足 共回答了22个问题
远方远足 共回答了22个问题 |采纳率90.9%锌离子不与水发生反应.首先你要了解这个原电池的方程式,本质就是:
Zn+2H+ → Zn2+ + H2↑
但分步写便会体现电子的转移:
Zn - 2e- → Zn2+
2H+ + 2e- → H2↑
也就是说.电子从锌那一及跑出来,锌变成锌离子,因为金属之间存在可以自由移动的电子(你们以后会学到),所以自由电子沿着金属导线跑到铜那里,水电离出的H+在铜那里得到锌失去的电子,变成氢气.这就是铜极产生了气体而锌极却没有.
如果中间没有导线.铜极不会有气体产生的.
注意:铜极产生气体是实验现象,不是本质.1年前查看全部
- 原电池与置换反应假设在一个稀硫酸溶液中,插入铁片和锌片,两片金属有导线连接,请问一下电流方向,以及氢气会哪产生?铁片和锌
原电池与置换反应
假设在一个稀硫酸溶液中,插入铁片和锌片,两片金属有导线连接,请问一下电流方向,以及氢气会哪产生?铁片和锌片都会和稀硫酸产生置换反应吗?还是只是有一段会变成离子溶入溶液? 日落雨1年前1
日落雨1年前1 -
 13660277804 共回答了20个问题
13660277804 共回答了20个问题 |采纳率90%电流:Fe是正极,Zn是负极;
Fe上产生H2;
Zn变成离子进入溶液.1年前查看全部
- (1)小南和小雄将一块铜片和一块锌片插入西红柿,做成了一个“西红柿电池”.小南和小雄在探究过程中,找来了电压表,连成如图
(1)小南和小雄将一块铜片和一块锌片插入西红柿,做成了一个“西红柿电池”.小南和小雄在探究过程中,找来了电压表,连成如图所示的电路.发现电压表示数为0.5V,因此他们探究出第一个结果是:________片是西红柿电池的正极.
(2)上题中为了探究西红柿电池的电压大小与哪些因素有关,小雄猜想说:“可能与两金属片之间的距离有关”;请你也提出一个合理的猜想:西红柿电池的电压大小还可能与_____________________________________________有关。
 zqq8ii1年前1
zqq8ii1年前1 -
 tianjiuliangle 共回答了19个问题
tianjiuliangle 共回答了19个问题 |采纳率84.2%(1)铜;(2)金属片插入西红柿中的深度、西红柿的成熟程度、金属片在西红柿中的面积等任一条即得分---每空2分。
:(1)由于电压表此时正向偏转,说明与正接线柱相连的铜片是电源的正极.
(2)该题为开放答案合理即可,如酸度、甜度、成熟度、形状.但不能写水果种类,因为题中限定了西红柿.1年前查看全部
- 下列各组中的物质充分反应后,所得溶液质量比反应前溶液质量减小的是( ) A.盐酸加入烧碱溶液中 B.锌片浸入硫酸铜溶液
下列各组中的物质充分反应后,所得溶液质量比反应前溶液质量减小的是( )
A.盐酸加入烧碱溶液中 B.锌片浸入硫酸铜溶液中 C.碳酸钠粉末加入稀盐酸中 D.二氧化碳通入足量石灰水中  赖妹1年前1
赖妹1年前1 -
 ngfbasobq 共回答了24个问题
ngfbasobq 共回答了24个问题 |采纳率95.8%D
1年前查看全部
- 将锌片分别插入下列溶液中,经过一段时间后取出,溶液的质量减轻的是( )
将锌片分别插入下列溶液中,经过一段时间后取出,溶液的质量减轻的是( )
A.盐酸
B.CuSO4 溶液
C.AgNO3 溶液
D.稀硫酸 dajiag1年前1
dajiag1年前1 -
 ruolanruolan 共回答了23个问题
ruolanruolan 共回答了23个问题 |采纳率95.7%解题思路:根据金属和酸反应放出氢气,以及金属与盐溶液的反应的规律写出反应的方程式;然后根据物质之间的反应以及反应的化学方程式进行计算.A、锌和稀盐酸反应生成氢气,根据质量守恒定律可知,生成氢气的质量比消耗锌的质量小,溶液质量增加,故A错误;
B、Zn+CuSO4═Cu+ZnSO4
6564
参加反应的锌为65,生成的铜质量为64,故锌片的质量减小,则溶液质量增加,故B错误;
C、Zn+2AgNO3═2Ag+Zn(NO3)2
65 216
锌和硝酸银参加反应的锌为65,生成的银质量为216,覆盖在锌的表面,使锌片的质量增加,则溶液质量减少,故C正确;
D、锌和稀硫酸反应生成氢气,根据质量守恒定律可知,生成氢气的质量比消耗锌的质量小,溶液质量增加,故D错误.
故选:C.点评:
本题考点: 金属的化学性质.
考点点评: 本题考查了金属与酸以及与盐之间反应的质量的计算,完成此题,可以依据金属活动性顺序及其意义并结合反应前后物质的质量关系进行.1年前查看全部
- 小明和小丽将一块铜片和一块锌片插入西红柿内,做成了一个“西红柿电池”.小明和小丽想探究“西红柿电池的电压大小与哪些因素有
小明和小丽将一块铜片和一块锌片插入西红柿内,做成了一个“西红柿电池”.小明和小丽想探究“西红柿电池的电压大小与哪些因素有关”,小丽说:“可能与两金属片之间的距离有关”,
如何判断正负极
设计记录表格 Kyou_baby1年前1
Kyou_baby1年前1 -
 jiangshuhua2 共回答了17个问题
jiangshuhua2 共回答了17个问题 |采纳率88.2%果酸电池的正负极就可以在化学课学到啦
电池的负极会失去电子 正极得到电子
也就是说 电子从负极出来 进入到正极
而谁失去电子谁得到电子就看金属的活泼性了
因为锌比铜活泼 所以锌容易失去电子 所以锌是负极
铜容易得到电子 铜是正极1年前查看全部
- 100mL浓度为2mol•L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
100mL浓度为2mol•L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
A.加入适量的6mol•L-1的盐酸
B.加入适量的氯化钠溶液或降温
C.加入适量CH3COOK溶液
D.加入2滴氯化铜溶液或碳粉 david_cao1年前1
david_cao1年前1 -
 咆哮狼 共回答了14个问题
咆哮狼 共回答了14个问题 |采纳率85.7%解题思路:过量的锌片,盐酸完全反应,则加快反应速率又不影响生成氢气的总量,可增大氢离子浓度或增大金属的接触面积、构成原电池等,不改变其氢离子物质的量即可,以此来解答.A.加入适量的6 mol•L-1的盐酸,反应速率加快,生成氢气增多,故A不选;
B.加入适量的氯化钠溶液,浓度减小,则反应速率减慢,降温,反应速率减小,故B不选;
C.加入适量CH3COOK溶液,生成弱酸,氢离子浓度减小,反应速率减小,故C不选;
D.加入2滴氯化铜溶液或碳粉,锌置换出铜,可形成原电池反应,反应速率增大,氢气的物质的量不变,故D选.
故选D.点评:
本题考点: 化学反应速率的影响因素.
考点点评: 本题考查影响化学反应速率的因素,注意把握浓度、接触面积对反应速率的影响即可解答,注重基础知识的考查,注意Zn过量盐酸完全反应,题目难度不大.1年前查看全部
- 将铜片、锌片和250mL稀硫酸组成的原电池,假设锌片只发生电化学腐蚀.当在铜片上放出6.72L(标准状况下)的气体时,H
将铜片、锌片和250mL稀硫酸组成的原电池,假设锌片只发生电化学腐蚀.当在铜片上放出6.72L(标准状况下)的气体时,H2S04恰好反应完全.
(1)该原电池的负极反应式为______
(2)原稀硫酸的物质的量浓度是______mol•L-1
(3)列式计算锌片减少的质量. ttQWERss1年前1
ttQWERss1年前1 -
 轩辕行素311 共回答了12个问题
轩辕行素311 共回答了12个问题 |采纳率100%解题思路:(1)该原电池中较活泼的金属锌作负极,负极上锌失电子发生氧化反应生成锌离子进入溶液,写出相应的电极反应式.
(2)锌和稀硫酸反应生成氢气,根据氢气体积和硫酸的关系式计算硫酸的物质的量浓度.
(3)根据锌和氢气之间的关系式计算锌减少的质量.(1)该原电池中较活泼的金属锌作负极,负极上锌失电子发生氧化反应生成锌离子进入溶液,正极上氢离子得电子生成氢气,所以负极上的电极反应式为:Zn-2e-=Zn2+,电池反应式为:Zn+2H+=Zn2++H2↑.
故答案为:Zn-2e-=Zn2+.
(2)设硫酸的物质的量浓度是C.
Zn+H2SO4=ZnSO4+H2↑
1mol22.4L
0.25Cmol 6.72L
C=1.2mol/L.
故答案为:1.2.
(3)设锌减少的质量为m.
Zn+H2SO4=ZnSO4+H2↑
65g 22.4L
m6.72L
m=19.5g
故答案为:19.5g.点评:
本题考点: 原电池和电解池的工作原理;氧化还原反应的计算.
考点点评: 本题考查了电极反应式的书写及物质的量的有关计算,难度不大,根据物质的物质的量之间的关系式来解答即可.1年前查看全部
- 把锌片放入下列溶液,溶液颜色有明显变化的是 A稀硫酸 B氯化铜溶液 C硝酸银溶液 D稀盐酸
把锌片放入下列溶液,溶液颜色有明显变化的是 A稀硫酸 B氯化铜溶液 C硝酸银溶液 D稀盐酸
反应的化学方程式是什么? lihao05161年前3
lihao05161年前3 -
 lapers 共回答了14个问题
lapers 共回答了14个问题 |采纳率85.7%当然是氯化铜溶液了
CuCl2+Zn=ZnCl2+Cu 置换反应
锌片溶解,铜析出1年前查看全部
- 高一化学两道选择题 只要答案下列物质属电解质的是 A胆矾B二氧化碳C新制的氯水D石墨 在铜-锌原电池中,锌片为A正极B负
高一化学两道选择题 只要答案
下列物质属电解质的是 A胆矾B二氧化碳C新制的氯水D石墨 在铜-锌原电池中,锌片为A正极B负极C阴极D阳极 yhq102251年前4
yhq102251年前4 -
 5201979100 共回答了15个问题
5201979100 共回答了15个问题 |采纳率93.3%下列物质属电解质的是 A胆矾B二氧化碳C新制的氯水D石墨(答案是A)
在铜-锌原电池中,锌片为A正极B负极C阴极D阳极(答案是B)补充:请问电极有阴阳极之分吗?哪个ZHU选C!1年前查看全部
- 小塑料块放在稀硫酸中,投入锌片塑料块上浮还是下沉
 天山牧羊1231年前3
天山牧羊1231年前3 -
 z0111 共回答了23个问题
z0111 共回答了23个问题 |采纳率95.7%上浮.
原来塑料的重力等于浮力.
投入锌片后,发生反应H2SO4 +Zn=ZnSO4 +H2
溶质是ZnSO4,密度变大,所以浮力变大.
那么塑料上浮.1年前查看全部
- 1.:100ml 2mol/l盐酸跟过量的锌片反应,为了加快反应速率,又不影响生成氢气总量,可采用的方法是( )
1.:100ml 2mol/l盐酸跟过量的锌片反应,为了加快反应速率,又不影响生成氢气总量,可采用的方法是( )
A 加入适量6mol/l盐酸 B加入数滴氯化铜溶液
C 加入适量蒸馏水 D加入实力氯化钠溶液
刚才的人说下话我加你分我要走了

 fly19911年前1
fly19911年前1 -
 紫色年代 共回答了18个问题
紫色年代 共回答了18个问题 |采纳率100%希望答案对您有所帮助!
答案选B,因为Zn是过量的,这就保证可以和CuCl2发生置换反应生成Cu.从而得到了铜锌原电池.而铜又不会和盐酸反应,只会加快反应速率,所以选B!
PS:A会增加氢气总量的
C会减缓反应速度
D也是减缓反应速度1年前查看全部
大家在问
- 1it's the first time that与sb is the first to do 的区别
- 2艾滋病传播的途径不包括( )A.性传播B.母婴传播C.血液传播D.接触传播
- 3估算某地形区的相对高度公式为:H高—H低
- 4为什么who在定语从句做主语不能省略,而who is却可以呢
- 5蜘蛛的哪种“感觉”能力特别优秀的?具体的
- 6(2011•南充)质量120g、体积20cm3的物体挂在弹簧测力计上,再把物体浸没在某种液体中,弹簧测力计的示数是1N,
- 7英语翻译U and tomo-kun re together as a lovely couple,ren't u^^不
- 8a减3括号的平方+b减6的绝对值等于零,则方程ax=b的解为多少?
- 9Rt三角形ABC,角ACB=90°,BC=2,如图1,将三角形ABC置于坐标系中,使BC边落在y轴正半轴上,点B位于原点
- 10失去以后才懂得珍惜,作文!作文关于珍惜现在的,还要符合题目别等到失去后才懂得珍惜!
- 110.86的计数单位是______,它有______个这样的计数单位,把它改写成与它大小相等的三位小数是______.
- 12高数极限小问题e的x的2次方减1,x趋于0,能用无穷小公式化成x的平方么?望懂的知情人士解答.
- 13如图, 在四边形ABCD中,AB=CD,BF=DE,AE⊥BD,CF⊥BD,垂足分别为E,F。
- 14How many classrooms are there in your school?
- 15判断一元一次方程下列方程中,有哪些是一元一次方程的?(1)5-6y=12(2)2x^2=2(x^2-x)(3) y-1/
