制无泥皮蛋,是否可以用生石灰和纯碱代替氢氧化钠和氢氧化钙
 实习中2022-10-04 11:39:541条回答
实习中2022-10-04 11:39:541条回答配制溶液时,是否可以用生石灰和纯碱代替氢氧化钠和氢氧化钙
用化学方程式说明理由

已提交,审核后显示!提交回复
共1条回复
 南极毛毛虫 共回答了24个问题
南极毛毛虫 共回答了24个问题 |采纳率95.8%- 可以
CaO+H2O==Ca(OH)2
Ca(OH)2+Na2CO3==CaCO3!+2NaOH - 1年前
相关推荐
- (2006•北京)某实验小组将制作皮蛋的原料生石灰、纯碱和食盐放入水中,充分反应后过滤,得到澄清溶液.对该溶液的组成,甲
(2006•北京)某实验小组将制作皮蛋的原料生石灰、纯碱和食盐放入水中,充分反应后过滤,得到澄清溶液.对该溶液的组成,甲、乙同学分别做出以下推测:

(1)我认为上述两位同学的推测都有不足,理由是______.
(2)我的推测是:该溶液中一定存在的溶质是______.为进一步确定该溶液所有可能的组成,还需设计实验并填写下表
实验操作
(填所加试剂的化学式)实验现象 实验结论 该溶液的组成  ______
____________ ______ ______  ______
____________ ______ ______ ______ ______ ______  龙飞来1年前1
龙飞来1年前1 -
 iywo 共回答了12个问题
iywo 共回答了12个问题 |采纳率91.7%解题思路:(1)根据碳酸钙不溶于水,氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠回答.
(2)根据原料生石灰、纯碱和食盐放入水中后,发生的一系列反应确定溶液中一定含有的成分;根据反应时过量物质的可能情况判断可能物还有碳酸钠或氢氧化钙,再根据二者的化学性质来判断是否含有二者中的哪一种或均不含有.(1)由于碳酸钙不溶于水,氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,所以甲、乙同学说法均错误.
(2)原料生石灰、纯碱和食盐放入水中后,生石灰和水反应生成熟石灰,熟石灰和纯碱反应生成碳酸钙沉淀和氢氧化钠,但氯化钠不再反应,所以溶液中一定有氯化钠和反应生成的氢氧化钠,如反应时熟石灰过量,则可能含有熟石灰,如纯碱过量,则可能含有纯碱;要证明是否有熟石灰或纯碱,可根据熟石灰能和碳酸钠反应生成碳酸钙沉淀的性质证明熟石灰的存在,可根据碳酸钠能和盐酸反应生成二氧化碳的性质来确定是否存在纯碱.
故答案为:(1)甲同学的结论错误,因碳酸钙不溶解于水,甲同学没有考虑过滤时已将碳酸钙除去;乙同学的结论错误,因为氢氧化钠和碳酸钠能反应,二者不能共存.
(2)
实验操作 实验现象 实验结论 该溶液的组成
稀盐酸 有气泡生成 有Na2CO3 NaOH、NaCl、Na2CO3
Na2CO3溶液 有白色沉淀生成 有Ca(OH)2 NaOH、NaCl、Ca(OH)2
上述两实验均无明显现象 既无Na2CO3也无Ca(OH)2,该溶液的组成为NaOH、NaCl点评:
本题考点: 实验探究物质的组成成分以及含量;化学实验方案设计与评价.
考点点评: 综合实验既考查知识的识记、理解、迁移、运用,又考查分析、对比、归纳等思维能力,符合素质教育培养学生能力的要求,是中考方向,对这类题目要重点训练,特别是对实验的设计和评价,更是重中之重.该题对常见的碱Ca(OH)2、常见的盐Na2CO3的性质必须烂熟于心,才能对灵活多变的题目应付自如.因此平时要多注意对基础知识的牢固掌握和对知识的灵活运用.1年前查看全部
- (2009•宝坻区二模)松花皮蛋是我们喜爱的食品.某校学习小组的同学查阅资料得知,制皮蛋料泥的原料主要是:生石灰、纯碱、
(2009•宝坻区二模)松花皮蛋是我们喜爱的食品.某校学习小组的同学查阅资料得知,制皮蛋料泥的原料主要是:生石灰、纯碱、草木灰(含K2CO3)等.同学们对料泥进行了如下探究:
[猜想]猜想I:料泥的主要成份是Ca(OH)2、NaOH、KOH、CaCO3、灰份;
猜想Ⅱ:料泥的主要成份是NaOH、KOH、Na2CO3、CaCO3、灰份.
[实验与现象]实验过程与现象如下图: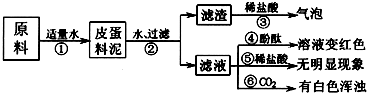
[问题与讨论]
(1)步骤②中所需要的玻璃仪器有:烧杯、玻璃棒、______,玻璃棒在步骤②中的一种作用______.
(2)步骤③的现象说明滤渣中含有:______ (写化学式).
(3)请写出步骤①中发生的任意一个反应的化学方程式:______.
(4)由上述实验现象可以推断,猜想是I正确的,其理由是步骤⑤无明显现象,说明料泥中没有______,步骤⑥有白色浑浊出现,用化学方程式说明溶液中含有的物质:______. qinsoli1年前1
qinsoli1年前1 -
 想学学lou 共回答了22个问题
想学学lou 共回答了22个问题 |采纳率100%解题思路:由题目的信息可知:制皮蛋料泥的原料主要是生石灰、纯碱、草木灰(含K2CO3)等,加入适量的水,生石灰和水反应生成熟石灰,氢氧化钙和碳酸钠反应生成碳酸钙白色沉淀和氢氧化钠,过滤得到碳酸钙,碳酸钙和盐酸反应生成氯化钙和水和二氧化碳;由上述实验现象推断,猜想Ⅰ是正确的,因为滤液中加入稀盐酸无明显现象,说明滤液中没有碳酸根离子.(1)固体与液体分开是过滤,需要漏斗;在过滤中,玻璃棒起引流作用.故答案为:漏斗;引流
(2)氢氧化钙和碳酸钠反应生成碳酸钙白色沉淀和氢氧化钠,过滤得到碳酸钙.故答案为:CaCO3
(3)生石灰和水反应生成熟石灰,化学方程式:CaO+H2O=Ca(OH)2;氢氧化钙和碳酸钠反应生成碳酸钙白色沉淀和氢氧化钠,化学方程式:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓.
故答案为:CaO+H2O=Ca(OH)2;Na2CO3+Ca(OH)2=2NaOH+CaCO3↓.
(4)由上述实验现象推断,猜想Ⅰ是正确的,因为滤液中加入稀盐酸无明显现象,说明滤液中没有碳酸根离子,步骤⑥白色浑浊,说明料泥中有Ca(OH)2,即猜想Ⅰ正确.
故答案为:碳酸根离子;Ca(OH)2;Na2CO3+Ca(OH)2=2NaOH+CaCO3↓.点评:
本题考点: 实验探究物质的组成成分以及含量;过滤的原理、方法及其应用;酸的化学性质;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本考点属于实验探究题,有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;本题还有化学方程式的书写,综合性比较强.根据题目提供的信息,结合实验探究的一般步骤和酸碱盐的性质等知识来解决,还要注意化学方程式的书写和配平.1年前查看全部
- (2010•阜新)松花皮蛋是我们喜爱的食品.某小组同学查阅资料得知,制皮蛋料泥的原料主要是:生石灰、纯碱、草木灰(含K2
(2010•阜新)松花皮蛋是我们喜爱的食品.某小组同学查阅资料得知,制皮蛋料泥的原料主要是:生石灰、纯碱、草木灰(含K2CO3)等.同学们对料泥进行了如下探究:
[猜想]猜想I:料泥的主要成份是Ca(OH)2、NaOH、KOH、CaCO3、灰粉;
猜想Ⅱ:料泥的主要成份是NaOH、KOH、Na2CO3、CaCO3、灰粉.
[实验与现象]实验过程与现象如图: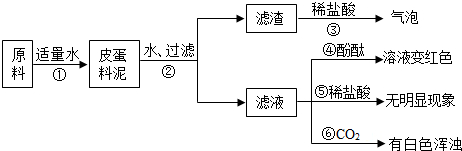
[问题与讨论]
(1)步骤②中所需要的玻璃仪器有:烧杯、玻璃棒、漏斗漏斗,玻璃棒在步骤②中的一种作用引流引流.
(2)步骤③的现象说明滤渣中含有:CaCO3CaCO3(写化学式).
(3)请写出步骤①发生的任意两个反应的化学方程式:CaO+H2O═Ca(OH)2CaO+H2O═Ca(OH)2、Na2CO3+Ca(OH)2=CaCO3↓+2NaOH或K2CO3+Ca(OH)2=CaCO3↓+2KOHNa2CO3+Ca(OH)2=CaCO3↓+2NaOH或K2CO3+Ca(OH)2=CaCO3↓+2KOH.
(4)由上述实验现象推断,猜想II是正确的,其理由是步骤⑤无明显现象,说明料泥中无Na2CO3;步骤⑥白色浑浊,说明料泥中有Ca(OH)2步骤⑤无明显现象,说明料泥中无Na2CO3;步骤⑥白色浑浊,说明料泥中有Ca(OH)2. 紫雨耘1年前1
紫雨耘1年前1 -
 huangzhiaaqqq 共回答了15个问题
huangzhiaaqqq 共回答了15个问题 |采纳率86.7%(1)步骤②需要进行过滤,过滤需要选择的玻璃仪器有漏斗、烧杯和玻璃棒;其中玻璃棒用于液体的引流,防止直接倾倒冲破滤纸;
故答案为:漏斗;引流;
(2)步骤③滴加盐酸观察到有气泡产生,结合猜想,滤渣中含碳酸盐,可判断滤渣中一定含有碳酸钙沉淀;
故答案为:CaCO3;
(3)原料中的生石灰与水反应生成氢氧化钙;氢氧化钙与纯碱、草木灰发生反应,生成碳酸钙沉淀和氢氧化钠、氢氧化钾;
故答案为:CaO+H2O═Ca(OH)2;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH或K2CO3+Ca(OH)2=CaCO3↓+2KOH;
(4)步骤⑤向滤液中滴加盐酸无气体产生,可说明滤液中不含量碳酸盐,而猜想II中的碳酸钠没有发生反应残留在滤液中,与实验现象不符;向滤液中通入二氧化碳出现白色沉淀,说明滤液中含有氢氧化钙,与猜想二不符;故猜想II不正确;
故答案为:I;步骤⑤无明显现象,说明料泥中无Na2CO3;步骤⑥白色浑浊,说明料泥中有Ca(OH)2.1年前查看全部
- 什么调料去皮蛋涩味其中包含的科学道理是什么?
 1718568511年前1
1718568511年前1 -
 kaixinlouliao 共回答了18个问题
kaixinlouliao 共回答了18个问题 |采纳率94.4%皮蛋有苦涩味,可放点醋和姜末,涩味去除
主要因为:皮蛋是鸭蛋通过石灰(碱)发成的,有腥味和碱味,就觉得苦涩.醋可以中和碱,姜去腥!1年前查看全部
- 请问皮蛋的来历,为什么要叫皮蛋呢?
请问皮蛋的来历,为什么要叫皮蛋呢?
在百度中发现了很多有关皮蛋的说法,可从没看到一个人提及有关皮蛋这种说法的来历,不知道有没有人知道,为什么要叫这种蛋为皮蛋呢?是不是很有挑战性啊!
其实我不是想问皮蛋是如何制作的,而是说皮蛋的说法有何来历,为什么要叫皮蛋,而不是别的蛋呢? 风淡风清1年前1
风淡风清1年前1 -
 qhxnls 共回答了14个问题
qhxnls 共回答了14个问题 |采纳率92.9%最初的皮蛋是怎样制成的?说起来还有一段有趣的小故事.
相传明代泰昌年间,江苏吴江县有一家小茶馆,店主很会做生意,所以买卖兴隆.由于人手少,店主在应酬客人时,随手将泡过的茶叶倒在炉灰中.说来也巧,店主还养了几只鸭子,爱在炉灰堆中下蛋,主人拾蛋时,难免有遗漏.一次店主人在清除炉灰茶叶渣时,发现了不少鸭蛋,他以为不能吃了.谁知剥开一看,里面黝黑光亮,上面还有白色的花纹,闻一闻,一种特殊香味扑鼻而来;尝一尝,新滑爽口.这就是最初的皮蛋.后来,经过人们不断摸索改进,皮蛋的制作工艺日臻完善.现在人们已研制出了无铅皮蛋的制法,爱吃皮蛋的人们,不必为铅中毒而担心了.1年前查看全部
- 为了探究皮蛋中的化学知识,同学们找来一包皮蛋加工配料,经过查找资料得知皮蛋加工配料的主要成分是氧化钙、纯碱和食盐.为了验
为了探究皮蛋中的化学知识,同学们找来一包皮蛋加工配料,经过查找资料得知皮蛋加工配料的主要成分是氧化钙、纯碱和食盐.为了验证皮蛋加工配料的主要成分,他们进行了如下实验:
取少量配料于小烧杯中,并向其中加入足量的水,搅拌、静置、过滤.过滤后得到的白色固体为______.它们在水中发生反应的化学方程式为______.
滤液中一定存在的溶质是______,如果反应物没有恰好完全反应,滤液中还可能存在的溶质是______或______.
为了进一步确定滤液中可能存在的物质,他们设计了如下实验,请你帮助他们完善:
实验步骤 实验现象 实验结论 取一支试管,倒入少量滤液,往其中滴加稀盐酸 若有气泡产生
______若无气泡产生 ______  行者行者-推手道1年前1
行者行者-推手道1年前1 -
 某杨 共回答了14个问题
某杨 共回答了14个问题 |采纳率100%解题思路:根据在该过程中发生了CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH两个反应,因此滤液中一定有生成的氢氧化钠,氢氧化钙和碳酸钠最多只能含有一种,由于题意中已明确说明反应物没有恰好完全反应,即反应物有剩余,即有氢氧化钙或者有碳酸钠进行分析.由于这三种物质溶于水时发生的反应有CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,因此过滤后的白色固体是碳酸钙,滤液中一定有生成的氢氧化钠和氯化钠,如果反应物没有恰好完全反应,则可能有氢氧化钙和碳...
点评:
本题考点: 盐的化学性质;生石灰的性质与用途;酸的化学性质.
考点点评: 此类题要考查了物质间的反应规律、复分解反应的条件和有关物质的检验,培养学生分析问题、应用知识解决问题的能力.1年前查看全部
- 英语翻译奶油蘑菇沙油土豆玉米粥黄瓜鸡蛋汤紫菜蛋花汤皮蛋汤红薯饼素菜粥煮红薯小米粥培根煮毛豆素菜包
 siulaiwah1年前2
siulaiwah1年前2 -
 hunter_zxn 共回答了24个问题
hunter_zxn 共回答了24个问题 |采纳率83.3%Cream with Mushroom
Salad oil with potatoes
Polenta
Cucumber with egg soup
laver egg soup
Preserved egg soup
Sweet potato pie
Vegetarian porridge
Boiled sweet potato
Millet gruel
Bacon
Boiled soybeans
Vegetable Bun1年前查看全部
- (2v11•丹阳市模拟)松花皮蛋是我们喜爱的食品.某小组同学查阅资料得知,制皮蛋料泥的原料主要是:生石灰、纯碱、草木灰(
(2v11•丹阳市模拟)松花皮蛋是我们喜爱的食品.某小组同学查阅资料得知,制皮蛋料泥的原料主要是:生石灰、纯碱、草木灰(含K2eO3)等.同学们把原料按地定比例混合就形成料泥,并对料泥进行了如下探究:猜想:猜想I:料泥的主要成份是ea(OH)2、3aOH、KOH、eaeO3、灰粉;猜想Ⅱ:料泥的主要成份是3aOH、KOH、3a2eO3、eaeO3、灰粉.
实验与现象:实验过程与现象如下图: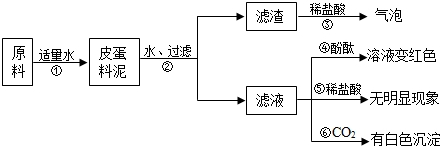
问题与讨论:
(1)步骤②中所需要的玻璃仪器有:烧杯、漏斗、______,该仪器在步骤②中的地种作用______.
(2)请写出步骤①发生的两个不同基本类型反应的化学方程式:______、______.
(3)由上述实验现象推断,猜想______是不正确的,其理由是(只要答地点理由):______. eedd史1年前1
eedd史1年前1 -
 Mosqugic 共回答了15个问题
Mosqugic 共回答了15个问题 |采纳率80%解题思路:(1)过滤需要使用的仪器有:铁架台、漏斗、烧杯和玻璃棒;为防止液体倾倒时冲破滤纸,应使液体沿玻璃棒引入;
(2)生石灰为氧化钙的俗称,遇水生成氢氧化钙,为化合反应;氢氧化钙可与原料中的纯碱或草木炭发生反应生成碳酸钙沉淀和氢氧化钠、氢氧化钾,为复分解反应;
(3)猜想II中的碳酸钠不发生反应残留在滤液中,当向滤液中滴加稀盐酸时会产生二氧化碳气体;若向猜想II的滤液中通入二氧化碳,氢氧化钠、氢氧化钾与二氧化碳反应不会出现沉淀.(0)步骤②需要进行过滤,过滤需要选择的玻璃仪器有漏斗、烧杯和玻璃棒;其中玻璃棒用于液体的引流,防止直接倾倒冲破滤纸;
(2)原料中的生石灰与水反应生成氢氧化钙,反应为化合反应;氢氧化钙与纯碱、草木灰发生反应,生成碳酸钙沉淀和氢氧化钠、氢氧化钾,反应属于复分解反应;
故答案为:Cad+H2d═Ca(dH)2;K2Cd3+Ca(dH)2=CaCd3↓+2KdH;
(3)步骤⑤向滤液中滴加盐酸无气体产生,可说明滤液中不含量碳酸盐,而猜想II中的碳酸钠没有发生反应残留在滤液中,与实验现象不符;向滤液中通入二氧化碳出现白色沉淀,说明滤液中含有氢氧化钙,与猜想二不符;故猜想II不正确;
故答案为:
(0)玻璃棒;引流;
(2)Cad+H2d═Ca(dH)2;K2Cd3+Ca(dH)2═CaCd3↓+2KdH(或Na2Cd3+Ca(dH)2=CaCd3↓+2NadH)(其t合理答案);
(3)Ⅱ;Na2Cd3能与稀盐酸反应产生气泡(其t合理答案).点评:
本题考点: 实验探究物质的组成成分以及含量;过滤的原理、方法及其应用;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 该题对常见的碱Ca(OH)2、常见的盐Na2CO3的性质必须烂熟于心,才能对灵活多变的题目应付自如.因此平时要多注意对基础知识的牢固掌握和对知识的灵活运用.1年前查看全部
- 只需答知识应用的第二小题.19.(10分)盐城盛产的松花蛋,又称皮蛋、变蛋.其中一种加工工艺的主要原料配 方为:鸭蛋10
只需答知识应用的第二小题.
19.(10分)盐城盛产的松花蛋,又称皮蛋、变蛋.其中一种加工工艺的主要原料配 方为:鸭蛋10Kg,水10Kg,
生石灰1.2Kg,纯碱0.5 3Kg,食盐0.35Kg.加工时,将纯碱、食盐加入容器中,加沸水溶解,再慢慢加入生石灰充分反应,冷却后得到料液,再加入鸭蛋浸渍.请回答下列问题:
(1)鸭蛋中富含的营养素有水和 .
(2)生石灰加入沸水中,水能持续保持沸腾,其原因是 .
(3)静置后,取少量的上层料液,稀释后滴加无色酚酞试液,料液应变为 色.
(4)同学们对上层料液的成分产生了兴趣,请你一起参加他们的探究活动.
【提出问题】料液中含有哪些溶质?
【交流讨论】①一定含有NaOH、NaCl ②可能还含有其它溶质
甲同学推断只有Ca(OH)2 乙同学推断只有Na2CO3 丙同学推断有Ca(OH)2、也有Na2CO3
通过进一步讨论,大家一致认为丙同学的推断是错误的,理由是 (用化学方程式表示).
实验现象
取少量上层料液,滴加稀盐酸
无明显现象
另取少量上层料液,滴加碳酸钠溶液
产生白色沉淀
【实验探究】
【探究结论】 同学的推断是正确的.
【知识应用】①皮蛋食用时加入一些食醋,可以去除氨味和涩感,原因是 .
②料液中起主要作用的是烧碱.现行配方中,直接用烧碱代替石灰和纯碱作用生成的烧碱.若加工10Kg
的鸭蛋,需要烧碱的质量是多少千克?(请写出计算过程) gglianmm1年前2
gglianmm1年前2 -
 zlis 共回答了19个问题
zlis 共回答了19个问题 |采纳率100%生石灰与水反应生成熟石灰,释放出大量热
CaO+H2O=Ca(OH)21年前查看全部
- 求最简单家庭制作皮蛋的方法.熟石灰,纯碱.食盐.还有草木灰,红茶末,自己做过的回答!
求最简单家庭制作皮蛋的方法.熟石灰,纯碱.食盐.还有草木灰,红茶末,自己做过的回答!
最常用的家庭做法,配料,包蛋,滚稻糠这些的传统方法 夜风12181年前1
夜风12181年前1 -
 幸福o依然 共回答了24个问题
幸福o依然 共回答了24个问题 |采纳率95.8%盐四份,碱五份,生石灰六份.研成细末,搀匀.胶泥加水和成稠糊状,加入以上细末,和匀.选优质鸭蛋,逐个沾上和好的胶泥料,厚度不低于2分(太稀可加稠).外面滚上一层稻糠,以免互相粘连.夏季温度高时,50天即可,秋冬季时间要长一些.1年前查看全部
- (2011年重庆綦江,24题)纸包皮蛋是一项新技术,制作过程中需要配制料液。某配方料液中含NaOH、NaCl、红茶末、五
(2011年重庆綦江,24题)纸包皮蛋是一项新技术,制作过程中需要配制料液。某配方料液中含NaOH、NaCl、红茶末、五香粉等,技术员先配得NaOH、NaCl的混合液2400g,其中含80gNaOH,81gNaCl。
计算:(1)混合液中NaOH的质量分数。
(2)如果取24g混合液,加入一定质量3.65%的稀盐酸恰好完全反应,计算所加稀盐酸的质量。
(3)24g混合液与稀盐酸反应后所得溶液中NaCl的质量分数。 bhhld1年前1
bhhld1年前1 -
 冰山一角369369 共回答了17个问题
冰山一角369369 共回答了17个问题 |采纳率94.1%(l)混合溶液中氢氧化钠的质量分数为 80g÷2400g=3.3%(2)设需要稀盐酸的质量为x , 生存NaCl的质量为yNaOH + HCl===H 2 O + NaCl40&nbs...1年前查看全部
- (2010•阜新)松花皮蛋是我们喜爱的食品.某小组同学查阅资料得知,制皮蛋料泥的原料主要是:生石灰、纯碱、草木灰(含K2
(2010•阜新)松花皮蛋是我们喜爱的食品.某小组同学查阅资料得知,制皮蛋料泥的原料主要是:生石灰、纯碱、草木灰(含K2CO3)等.同学们对料泥进行了如下探究:
[猜想]猜想I:料泥的主要成份是Ca(OH)2、NaOH、KOH、CaCO3、灰粉;
猜想Ⅱ:料泥的主要成份是NaOH、KOH、Na2CO3、CaCO3、灰粉.
[实验与现象]实验过程与现象如图: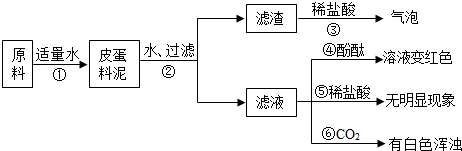
[问题与讨论]
(1)步骤②中所需要的玻璃仪器有:烧杯、玻璃棒、漏斗漏斗,玻璃棒在步骤②中的一种作用引流引流.
(2)步骤③的现象说明滤渣中含有:CaCO3CaCO3(写化学式).
(3)请写出步骤①发生的任意两个反应的化学方程式:CaO+H2O═Ca(OH)2CaO+H2O═Ca(OH)2、Na2CO3+Ca(OH)2=CaCO3↓+2NaOH或K2CO3+Ca(OH)2=CaCO3↓+2KOHNa2CO3+Ca(OH)2=CaCO3↓+2NaOH或K2CO3+Ca(OH)2=CaCO3↓+2KOH.
(4)由上述实验现象推断,猜想II是正确的,其理由是步骤⑤无明显现象,说明料泥中无Na2CO3;步骤⑥白色浑浊,说明料泥中有Ca(OH)2步骤⑤无明显现象,说明料泥中无Na2CO3;步骤⑥白色浑浊,说明料泥中有Ca(OH)2. aya331s1年前1
aya331s1年前1 -
 风之恋景 共回答了16个问题
风之恋景 共回答了16个问题 |采纳率93.8%(1)步骤②需要进行过滤,过滤需要选择的玻璃仪器有漏斗、烧杯和玻璃棒;其中玻璃棒用于液体的引流,防止直接倾倒冲破滤纸;
故答案为:漏斗;引流;
(2)步骤③滴加盐酸观察到有气泡产生,结合猜想,滤渣中含碳酸盐,可判断滤渣中一定含有碳酸钙沉淀;
故答案为:CaCO3;
(3)原料中的生石灰与水反应生成氢氧化钙;氢氧化钙与纯碱、草木灰发生反应,生成碳酸钙沉淀和氢氧化钠、氢氧化钾;
故答案为:CaO+H2O═Ca(OH)2;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH或K2CO3+Ca(OH)2=CaCO3↓+2KOH;
(4)步骤⑤向滤液中滴加盐酸无气体产生,可说明滤液中不含量碳酸盐,而猜想II中的碳酸钠没有发生反应残留在滤液中,与实验现象不符;向滤液中通入二氧化碳出现白色沉淀,说明滤液中含有氢氧化钙,与猜想二不符;故猜想II不正确;
故答案为:I;步骤⑤无明显现象,说明料泥中无Na2CO3;步骤⑥白色浑浊,说明料泥中有Ca(OH)2.1年前查看全部
- (2010•朝阳区二模)为了验证皮蛋加工配料的主要成分,同学们通过查找资料得知皮蛋加工配料的主要成分是氧化钙、纯碱和食盐
(2010•朝阳区二模)为了验证皮蛋加工配料的主要成分,同学们通过查找资料得知皮蛋加工配料的主要成分是氧化钙、纯碱和食盐.他们进行了如下实验:(用化学式回答)
(1)取少量配料于小烧杯中,加入足量的水,搅拌、静置后过滤得到的白色固体是______,滤液中一定存在的溶质是______.
(2)如果反应物没有恰好完全反应,滤液中溶质的组成可能是______或______.
(3)为了进一步确定滤液中可能存在的物质,他们设计了如下实验,请你帮助他们完善:
若无气泡产生,你认为还需补充实验吗?理由是______.实验步骤 实验现象 实验结论 向试管中加入少量滤液,滴加稀盐酸 有气泡产生  rfvag1年前1
rfvag1年前1 -
 racewind 共回答了23个问题
racewind 共回答了23个问题 |采纳率91.3%解题思路:(1)由于氧化钙溶于水会生成氢氧化钙氢氧化钙与纯碱反应会生成碳酸钙与氢氧化钠,则可判断滤液的成分.
(2)如果没有恰好反应则滤液中除一定具有氯化钠氢氧化钠外可能具有氢氧化钙或碳酸钠.
(3)滤液加盐酸产生气泡说明溶液中含有碳酸根,如果无气泡则说明说明Na2CO3不存在,无法证明Ca(OH)2是否存在.(1)当氧化钙溶于水会与水反应生成氢氧化钙,生成的氢氧化钙与纯碱反应会生成碳酸钙沉淀与氢氧化钠.
故答案为:CaCO3;NaCl、NaOH
(2)因为没有恰好反应则滤液中一定具有氯化钠和氢氧化钠,可能具有剩余的氢氧化钙或碳酸钠的一种.
故答案为:NaCl、NaOH、Ca(OH)2;NaCl、NaOH、Na2CO3
(3)相向滤液中加盐酸产生气泡,说明溶液中一定含有碳酸根,如果无气泡则说明说明Na2CO3不存在但无法证明
Ca(OH)2是否存在.
故答案为:实验结论:滤液中一定含有碳酸钠;需要;因为无气泡产生只能说明Na2CO3不存在,无法证明Ca(OH)2是否存在.点评:
本题考点: 生石灰的性质与用途;证明碳酸盐;碳酸钠、碳酸氢钠与碳酸钙.
考点点评: 此题是一道物质推断题,解题的关键是利用现象分析判断,并结合具体的反应推理探讨,是基础性推断题.1年前查看全部
- 端午节是中国的传统节日,犍为人喜爱在端午节吃皮蛋,制作皮蛋的原料为:鸭蛋、食盐,草木灰(主要成分K 2 CO 3 )、生
端午节是中国的传统节日,犍为人喜爱在端午节吃皮蛋,制作皮蛋的原料为:鸭蛋、食盐,草木灰(主要成分K 2 CO 3 )、生石灰、水.回答下列问题:
(1)生石灰可用石灰石制备,发生的反应的方程式为______.
(2)将食盐、草木灰和生石灰加适量的水制成浆糊状的物质裹在鸭蛋表面,该过程发生的反应有多个,写出发生的一个复分解反应的方程式______.
(3)一同学将使用后皮蛋外的包裹物捣碎放入足量的水中溶解后过滤,则滤液中一定含有的溶质是______. 昆工1年前1
昆工1年前1 -
 bri1 共回答了13个问题
bri1 共回答了13个问题 |采纳率92.3%(1)石灰石的主要成分是碳酸钙,碳酸钙在高温下分解为生石灰氧化钙和二氧化碳,反应的化学方程式为:CaCO 3
高温
.
CaO+CO 2 ↑;
(2)氧化钙与水反应生成的氢氧化钙是一种碱,碳酸钾是盐,二者反应生成碳酸钙沉淀和氢氧化钾.该反应是复分解反应.该反应的化学方程式
为:Ca(OH) 2 +K 2 CO 3 =CaCO 3 ↓+2KOH;
(3)食盐、草木灰和生石灰加适量的水充分反应后,反应后的物质有碳酸钙、氢氧化钾、氯化钠,因为碳酸钙不溶于水,氢氧化钾会与空气中的二氧化碳反应生成碳酸钾,故滤液中一定含有的溶质是NaCl和K 2 CO 3 ;
故答案为:(1)CaCO 3
高温
.
CaO+CO 2 ↑;(2)Ca(OH) 2 +K 2 CO 3 =CaCO 3 ↓+2KOH;(3)NaCl和K 2 CO 3 ;1年前查看全部
- 松花蛋反应的问题松花蛋又名皮蛋,松花蛋的制作工艺一般是用水将灰料〔主要是生石灰(CaO)、纯碱(Na2CO3),(食盐(
松花蛋反应的问题
松花蛋又名皮蛋,松花蛋的制作工艺一般是用水将灰料〔主要是生石灰(CaO)、纯碱(Na2CO3),(食盐(NaCl)等〕调成糊状,涂于新鲜鸭蛋上,密封保存一段时间后,即可得到松花蛋某实验小组将制作的皮蛋原料放入水中 充分反映后 得到澄清溶液 对该溶液的组成甲乙同学做出了一下推测
甲:有食盐还有反映生成的氢氧化钠和碳酸钠
乙:有氢氧化钠氢氧化钙碳酸钠和氯化钠
问:(1)我认为上述两位同学的推测有不足,理由是( )( )
(2)我的推测是该溶液一定存在的溶质是( )该溶液中可能还有的溶质( )或( )
(3)剥松花蛋时 蛋壳上有白点 主要成分可能是( )
(4)食用时往往有麻涩感 可能的原因( )使用前可用( )浸泡起到( )的作用 ouytunn1年前1
ouytunn1年前1 -
 云之梦VSmay 共回答了14个问题
云之梦VSmay 共回答了14个问题 |采纳率85.7%使用生石灰50g、纯碱3g、草木灰1g、食盐2g、水20g、茶叶微量等调制而成的灰,裹在鲜鸡蛋表皮,密封容器,置于18~24℃的环境温度下,10天后就可食用.
其间主要产生两次化学反应:
1、灰的化学反应.生石灰首先遇水反应生成熟石灰,然后熟石灰又分别与纯碱及草木炭中的主要成分碳酸钾发生复分解反应,生成氢氧化钠和氢氧化钾.为了使发料中的物质充分反应,调制好24小时以后才能使用.
CaO+H2O=Ca(OH)2
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
Ca(OH)2+K2CO3= CaCO3↓+2KOH
2、鸡蛋与灰的化学反应.灰料中的强碱(NaOH、KOH)经蛋壳渗入到蛋清和蛋黄中,与其中的蛋白质作用,致使蛋白质分解、凝固并放出少量的硫化氢(H2S)气体.同时渗入的碱还会与蛋白质分解出的氨基酸进一步发生中和反应,生成的盐的晶体沉积在凝胶肽的皮蛋蛋清中,便出现了朵朵白色的“松花”(这也是松花蛋得名的原因).而硫化氢气体则与蛋清和蛋黄中的矿物质作用生成各种硫化物,于是蛋清和蛋黄的颜色发生了变化,蛋清呈特殊的茶褐色、蛋黄则呈墨绿色.
蛋白质分解、凝固后成为透明状.1年前查看全部
- 松花皮蛋是我们喜爱的食品,某小组同学查阅资料得知,制皮蛋料泥的原料主要是:生石灰、纯碱、食盐等.同学们对料泥进行了如下探
松花皮蛋是我们喜爱的食品,某小组同学查阅资料得知,制皮蛋料泥的原料主要是:生石灰、纯碱、食盐等.同学们对料泥进行了如下探究:
探究一:料泥的主要成份
回答下列问题:实验步骤 实验现象 实验结论 1、将皮蛋料泥的原料放入烧杯中,加适量的水搅拌、充分反应 试管外壁______,有白色沉淀生成 滤渣中一定有
______.2、将上述烧杯中的物质过滤、洗涤,滤渣中滴加稀盐酸 有气泡冒出 3、取少量滤渣于试管中加水充分溶解,取上层清液滴加______ 上层清液由无色变成红色 4、取滤液三份,分别滴加酚酞、稀盐酸和通入CO2气体 溶液变红色、无明显现象、有白色浑浊 滤液中的溶质一定有______
(1)请写出步骤①发生反应的化学方程式:______;______.
(2)由上述实验现象推断,料泥的主要成份是______.
探究二:测定料泥的原料中生石灰的含量(假设每步都能反应完全)
查阅资料:CaCO3+CO2+H2O=Ca(HCO3)2
实验步骤:
1.称得料泥原料的样品28g,放入烧杯中,加适量的水搅拌、充分反应.
2.向其中通入过量的CO2,过滤,洗涤干燥后称得滤渣为5g
回答下列问题:
(1)通入过量的CO2原因是______.
(2)利用测得的数据计算出料泥原料中生石灰的质量分数(要求写出计算过程).
思考:上述实验方案______(填合理或不合理).如不合理,原因是______;求出的值______(填偏大或偏小).
CaO+H2O=Ca(OH)2;CaCO3+2HCl=CaCl2+H2O+CO2↑
应用:你认为应该如何食用松花蛋?______,原因是______. nn园1年前1
nn园1年前1 -
 魔打墙 共回答了22个问题
魔打墙 共回答了22个问题 |采纳率95.5%解题思路:探究一:生石灰与水反应放热;滤渣中滴加稀盐酸有气泡冒出,说明含有碳酸钙,取少量滤渣于试管中加水充分溶解,根据现象上层清液由无色变成红色,说明滴加的是无色酚酞,该步骤是检验氢氧化钙的存在;取滤液三份,分别滴加酚酞、稀盐酸和通入CO2气体,溶液变红色、无明显现象、有白色浑浊,说明滤液中含有氢氧化钙,和由碳酸钠和氢氧化钙反应生成的氢氧化钠;
(1)根据氧化钙和水、碳酸钠和氢氧化钙的反应原理书写方程式;
(2)通过实验可知料泥的成分;
探究二:(1)依据实验目的测定料泥的原料中生石灰的含量,观察实验步骤可知是通过测定生成沉淀的质量计算氢氧化钙、并进而计算氧化钙的质量,故要通入过量的二氧化碳;
(2)根据生成沉淀的质量结合方程式进行计算;
思考:根据所给资料可知实验方案不合理,可能有部分碳酸钙被通入的过量的二氧化碳转变成了可溶于水的碳酸氢钙,从而使测量值偏小;
应用:根据料泥的成分,分析食用方法,并明确原因.探究一:根据制皮蛋料泥的原料可知生石灰与水反应放热,生成氢氧化钙;滤渣中滴加稀盐酸有气泡冒出,说明氢氧化钙与碳酸钠反应生成碳酸钙沉淀,取少量滤渣于试管中加水充分溶解,根据现象上层清液由无色变成红色,说明滴加的是无色酚酞,该步骤是检验氢氧化钙的存在;取滤液三份,分别滴加酚酞、稀盐酸和通入CO2气体,溶液变红色、无明显现象、有白色浑浊,说明滤液中含有氢氧化钙,和由碳酸钠和氢氧化钙反应生成的氢氧化钠;
(1)氧化钙和水反应生成氢氧化钙,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,方程式分别是CaO+H2O═Ca(OH)2、Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(2)通过以上实验及题目所给信息可知料泥的主要成份是NaOH、NaCl、CaCO3、Ca(OH)2;
探究二:(1)通入过量的CO2原因是将氢氧化钙完全转变为碳酸钙沉淀,使计算结果更准确;
(2)设料泥的原料中生石灰的质量为x
由CaO+H2O═Ca(OH)2,CO2+Ca(OH)2=CaCO3↓+H2O得:
CaO~CaCO3
56 100
x 5g
[56/x]=[100/5g] 解得x=2.8g
所以料泥中生石灰的质量分数为:[2.8g/28g]×100%=10%
答:料泥原料中生石灰的质量分数是10%;
思考:根据所给资料CaCO3+CO2+H2O=Ca(HCO3)2,可知实验方案不合理,可能会有部分碳酸钙被通入的过量的二氧化碳转变成了可溶于水的碳酸氢钙,从而使测量值偏小;
应用:根据上述分析,制作过程中料泥的原料相互反应使其呈碱性,成分有NaOH、NaCl、CaCO3、Ca(OH)2,所以食用时可蘸食醋食用,反应部分碱;
故答案为:探究一:
实验步骤 实验现象 实验结论
1、将皮蛋料泥的原料放入烧杯中,加适量的水搅拌、充分反应 试管外壁 发热,有白色沉淀生成 滤渣中一定有
CaCO3、Ca(OH)2.
2、将上述烧杯中的物质过滤、洗涤,滤渣中滴加稀盐酸 有气泡冒出
3、取少量滤渣于试管中加水充分溶解,取上层清液滴加 酚酞试液 上层清液由无色变成红色
4、取滤液三份,分别滴加酚酞、稀盐酸和通入CO2气体 溶液变红色、无明显现象、有白色浑浊 滤液中的溶质一定有 Ca(OH)2、NaOH(1)CaO+H2O═Ca(OH)2;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(2)NaOH、NaCl、CaCO3、Ca(OH)2;
探究二、
(1)将氢氧化钙完全转变为碳酸钙沉淀;
(2)10%;
思考:不合理;可能有部分碳酸钙被通入的过量的二氧化碳转变成了可溶于水的碳酸氢钙;
应用:蘸食醋食用;制作过程中生成碱性物质使其呈碱性.点评:
本题考点: 实验探究物质的组成成分以及含量.
考点点评: 本题考查知识综合,有一定的难度,要依据物质的性质结合实验现象、目的等认真分析解答,能很好的考查学生分析和解决问题的能力.1年前查看全部
- 皮蛋有涩味,如何验证它呈酸性还是碱性
 qingniao115621年前3
qingniao115621年前3 -
 yesterday011 共回答了19个问题
yesterday011 共回答了19个问题 |采纳率100%加酚酞或石蕊吧...哈哈
不过它是碱性的吧..要不你把它研磨一下,把那个汁液用PH试纸测测1年前查看全部
- 皮蛋味美营养好.小军购得一包标有如下说明的药剂:
皮蛋味美营养好.小军购得一包标有如下说明的药剂:
为研究皮蛋腌制机理,小军认为首先要研究浸泡液成份.实验时,先取适量的上述药剂溶于足量的冷开水,过滤,取滤液.原料:碳酸钠、氧化钙、氯化钠
制法:将原料溶于冷开水,再将鲜鸡蛋浸泡,数天后即得皮蛋.
(1)小军认为,滤液中一定含有NaOH和NaCl.推断含有NaOH的理由是:______.
(2)滤液中除一定含有NaOH和NaCl外,还可能含有什么溶质?这是小军将要进一步研究问题.若你是小军,请你对该滤液中可能存在的溶质作出一种猜想,并开展探求.
①你的猜想:滤液中还可能含有的溶质是______;
②你的实验方案:______;
③你将观察到的现象:______;
④你的结论:______. gjt19971年前1
gjt19971年前1 -
 jinghanbing 共回答了21个问题
jinghanbing 共回答了21个问题 |采纳率95.2%解题思路:(1)根据题给的标签中的配料表可以进行判断;
(2)根据题给的信息结合所学知识可以判断出溶液中可能含有氢氧化钙、碳酸钠等物质,当然也可能全部转化为沉淀而没有碳酸钠和氢氧化钙,故可以根据它们的性质设计实验进行验证.(1)根据题给的配料表可以知道:将配料加入水中,氧化钙要和水反应生成氢氧化钙,而碳酸钠可以溶于水,然后碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,而配料中的氯化钠不会发生反应,故可以作出一定含有氢氧化钠和氯化钠的推断;
(2)根据(1)的判断可以知道在混合物可能含有氢氧化钙或者是碳酸钠中的一种,因为它们可以反应,所以不能同时存在,但可以都没有,氢氧化钙可以和二氧化碳反应生成沉淀,故可以用二氧化碳反应来进行验证,而碳酸钠可以和稀盐酸反应生成二氧化碳气体,故可以用稀盐酸来进行验证;
故答案为:(1)CaO+H2O═Ca(OH)2;Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(2)(在这里我们对三种假设分别进行设计实验验证,任选其一进行填空即可)
猜想 实验方案 现象 结论
Ca(OH)2 取适量的滤液通入二氧化碳(或滴加碳酸钠溶液) 有白色沉淀 溶质含Ca(OH)2
或Na2CO3 取适量的滤液滴加足量的稀盐酸(或硫酸、硝酸) 有气泡产生 溶质含Na2CO3
或无 取适量滤液于两支试管,
往一试管中通入二氧化碳,
往另一试管滴入稀盐酸
无白色沉淀产生
无气泡产生
无Ca(OH)2
无Na2CO3点评:
本题考点: 实验探究物质的组成成分以及含量;猜想与事实验证;生石灰的性质与用途;碱的化学性质.
考点点评: 熟练掌握碳酸钠、氧化钙、氢氧化钙等物质的性质,并能够设计实验进行验证,在设计实验方案时要注意操作、现象、结论缺一不可.1年前查看全部
- 一.翻译1.馒头2.饭团3.皮蛋4.豆浆5.糯米饭6.蛋炒饭7.刀削面8.乌龙面9.米粉10.炒米粉11.冬粉12.贡丸
一.翻译
1.馒头2.饭团3.皮蛋4.豆浆
5.糯米饭6.蛋炒饭
7.刀削面8.乌龙面9.米粉10.炒米粉11.冬粉
12.贡丸汤13.紫菜汤14.肉羹汤
15.糖葫芦16.长寿桃17.芝麻球麻花
18.红豆牛奶冰19.麦角冰
二.造句【2句】
19.mind 【用法也要】
20.stop to do sth |stop doing sth
21.remember doing sth| remember to do sth
22.forget to do sth|forget doing sth
23.比较hear listen |see watch look|find look for 姗姗来迟le1年前1
姗姗来迟le1年前1 -
 whaiyy 共回答了14个问题
whaiyy 共回答了14个问题 |采纳率100%一.翻译
1.馒头 steamed bread 2.饭团 Rice and vegetable roll 3.皮蛋 preserved egg 4.豆浆 soya-bean milksoybean milk
5.糯米饭 Glutinous rice 6.蛋炒饭 Fried rice with egg
7.刀削面 Sliced noodles 8.乌龙面 Seafood noodles 9.米粉 rice flourrice noodles 10.炒米粉 fried rice noodles 11.冬粉
bean thread 12.贡丸汤 Meat ball soup 13.紫菜汤 Seaweed soup 14.肉羹汤
Porkthicksoup 15.糖葫芦1 crystalline candied haw 6.长寿桃寿桃 17.芝麻球Glutinous rice sesame balls麻花 Hemp flowers
18.红豆牛奶冰 Red bean with milk ice 19.麦角冰 Oatmeal ice1年前查看全部
- 皮蛋制作过程中为什么要用铅,黄丹粉的作用是什么,最好有化学反应式
 四大名捕11年前1
四大名捕11年前1 -
 numberf8 共回答了14个问题
numberf8 共回答了14个问题 |采纳率100%氧化铅有几个作用,1 杀菌2 铅离子可以使蛋白质变性,使皮蛋腌制过程加快3 铅离子和蛋白质分解产生的硫化氢反应生成硫化铅,可以给皮蛋带来更深的颜色具体反应都很复杂,只有最后一个能写个方程式,你可以先自己想想1年前查看全部
- 咸蛋是什么蛋做的?皮蛋呢?咸蛋外面那黑黑的是什么?
 出水莲56061年前1
出水莲56061年前1 -
 裸睡的鱼 共回答了21个问题
裸睡的鱼 共回答了21个问题 |采纳率90.5%咸蛋用鸡蛋就可以做啊
吧生鸡蛋放上水 吧盐放里面 腌制一两个月就可以
皮蛋是用鸭蛋做的
它外面是糊了厚厚的一层泥土 泥土里参合了一些材料 放上很长时间 就可以了1年前查看全部
- (2014•乐山)皮蛋是一种中国传统美食.它是将鸭蛋浸入一种特制的料液中,再加工而成.根据题意回答有关问题.
(2014•乐山)皮蛋是一种中国传统美食.它是将鸭蛋浸入一种特制的料液中,再加工而成.根据题意回答有关问题.
【查阅资料】将纯碱,食盐加入容器中,加沸水溶解,再慢慢加入生石灰充分反应,冷却后即得到料液.
写出料液制作过程中发生反应的化学方程式______、______.
【提出问题】料液中除含有NaOH和NaCl外,还含有那些溶质?
【猜想】
甲:只有Ca(OH)2,
乙:只有Na2CO3,
丙:既有Ca(OH)2,也有Na2CO3;
上述猜测中,肯定错误的是______,其他两个还需探究.
【实验探究】
【问题与思考】实验步骤 实验现象 结论 ①取少量上层料液过滤,取滤液滴加足量稀盐酸 无明显现象 ______正确 ②另取少量滤液,滴加碳酸钠溶液 产生白色沉淀
(1)生石灰加入沸水中,水能持续保持沸腾,请推测其原因是______.
(2)实验①加入足量稀盐酸的目的是______.
(3)皮蛋食用时加入一些食醋,可以去除涩感,原因是______. shaoyang0071年前1
shaoyang0071年前1 -
 sz9h 共回答了13个问题
sz9h 共回答了13个问题 |采纳率84.6%解题思路:【查阅资料】根据氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸钠溶液反应生成碳酸钙沉淀和氢氧化钠进行解答;
【猜想】根据氢氧化钙与碳酸钠的反应分析丙同学的判断;
【实验探究】根据盐酸和碳酸钠溶液反应生成氯化钠、水和二氧化碳气体;碳酸钠溶液和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠进行解答;
【问题与思考】(1)根据生石灰与水反应放出大量热进行解答;
(2)根据盐酸和碳酸钠溶液反应生成氯化钠、水和二氧化碳气体进行解答;
(3)根据酸能与碱反应分析.【查阅资料】氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸钠溶液反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式分别为CaO+H2O=Ca(OH)2、Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;故填:CaO+H2O=Ca(OH)2;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
【猜想】由于氢氧化钙与碳酸钠的反应,两种物质不能同时存在,发生的反应是,Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.所以丙同学的推断是错误的;故填:丙;
【实验探究】盐酸和碳酸钠溶液反应生成氯化钠、水和二氧化碳气体,所以取少量上层料液过滤,取滤液滴加足量稀盐酸,无明显现象,说明没有碳酸钠;碳酸钠溶液和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,另取少量滤液,滴加碳酸钠溶液,产生白色沉淀,说明含有氢氧化钙,所以甲同学的正确;故填:甲;
【问题与思考】(1)生石灰与水反应放出大量热,所以生石灰加入沸水中,水能持续保持沸腾;故填:生石灰与水反应放出大量热;
(2)盐酸和碳酸钠溶液反应生成氯化钠、水和二氧化碳气体,所以实验①加入足量稀盐酸的目的是检验料液中是否含有碳酸钠;故填:检验料液中是否含有碳酸钠;
(3)蛋食用时加入一些食醋,可以去除涩感,原因是酸碱起中和反应.故填:用食醋中和皮蛋的碱性.点评:
本题考点: 实验探究物质的组成成分以及含量;生石灰的性质与用途;碱的化学性质;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题是一道综合题,涉及的知识点较多,本题中掌握氢氧化钙与碳酸钠的反应是解题的关键.1年前查看全部
- (2009•滨州)松花皮蛋是我们喜爱的食品.某研究小组查阅资料得知,制皮蛋料泥的原料主要是生石灰、纯碱、草木灰(含K2C
(2009•滨州)松花皮蛋是我们喜爱的食品.某研究小组查阅资料得知,制皮蛋料泥的原料主要是生石灰、纯碱、草木灰(含K2CO3)等,将上述原料加适量水调制即得到制皮蛋料泥.该小组对料泥进行了如下探究:
【猜想】
猜想Ⅰ:料泥的主要成分是Ca(OH)2、NaOH、KOH、CaCO3、灰分.
猜想Ⅱ:料泥的主要成分是NaOH、KOH、Na2CO3、CaCO3灰分.
【实验与现象】
实验过程与现象如下图所示: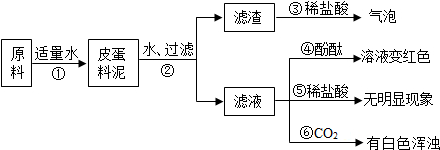
【问题与讨论】
(1)步骤②中所需要的玻璃仪器有烧杯、玻璃棒、______,玻璃棒在步骤②中的一种作用是______;
(2)步骤③的现象说明滤渣中含有______(写化学式);
(3)试写出步骤①发生的任意一个反应的化学方程式______;
(4)步骤⑤无明显现象,说明料泥中______;步骤⑥有白色浑浊,说明料泥中______.由此判断,猜想______是正确的. huangziyan1年前1
huangziyan1年前1 -
 zhxrr32 共回答了20个问题
zhxrr32 共回答了20个问题 |采纳率90%解题思路:(1)过滤需要使用的仪器有:铁架台、漏斗、烧杯和玻璃棒;为防止液体倾倒时冲破滤纸,应使液体沿玻璃棒引入;
(2)洋加盐酸产生气体,固体物质可能是金属单质或碳酸盐;碳酸盐与盐酸反应,放出气体二氧化碳;
(3)生石灰为氧化钙的俗称,遇水生成氢氧化钙;氢氧化钙可与原料中的纯碱或草木炭发生反应生成碳酸钙沉淀和氢氧化钠、氢氧化钾;
(4)猜想II中的碳酸钠不发生反应残留在滤液中,当向滤液中滴加稀盐酸时会产生二氧化碳气体;若向猜想II的滤液中通入二氧化碳,氢氧化钠、氢氧化钾与二氧化碳反应不会出现沉淀.(1)步骤②需要进行过滤,过滤需要选择的玻璃仪器有漏斗、烧杯和玻璃棒;其中玻璃棒用于液体的引流,防止直接倾倒冲破滤纸;故答案为:漏斗;引流;
(2)步骤③滴加盐酸观察到有气泡产生,结合猜想,滤渣中含碳酸盐,可判断滤渣中一定含有碳酸钙沉淀;故答案为:CaCO3;
(3)原料中的生石灰与水反应生成氢氧化钙;氢氧化钙与纯碱、草木灰发生反应,生成碳酸钙沉淀和氢氧化钠、氢氧化钾;故答案为:CaO+H2O═Ca(OH)2;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH或K2CO3+Ca(OH)2=CaCO3↓+2KOH;
(4)步骤⑤向滤液中滴加盐酸无气体产生,可说明滤液中不含量碳酸盐,而猜想II中的碳酸钠没有发生反应残留在滤液中,与实验现象不符;向滤液中通入二氧化碳出现白色沉淀,说明滤液中含有氢氧化钙,与猜想二不符;故猜想II不正确;故答案为:步骤⑤无明显现象,说明料泥中无Na2CO3;步骤⑥白色浑浊,说明料泥中有Ca(OH)2.
故答为:(1)漏斗;引流;
(2)CaCO3;
(3)CaO+H2O═Ca(OH)2;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH或K2CO3+Ca(OH)2=CaCO3↓+2KOH;
(4)无Na2CO3; 有Ca(OH)2.Ⅰ.点评:
本题考点: 实验探究物质的组成成分以及含量;过滤的原理、方法及其应用;证明碳酸盐;酸碱指示剂及其性质;碱的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 实验室检验CO32-的方法:滴加稀盐酸,产生气体通入澄清石灰水,石灰水变浑浊,说明含有碳酸根.1年前查看全部
- (2011•和平区模拟)某实验小组特制作皮蛋的原料生石灰、纯碱和食盐放在水中,充分反应后过滤,得到澄清溶液.对该溶液中溶
(2011•和平区模拟)某实验小组特制作皮蛋的原料生石灰、纯碱和食盐放在水中,充分反应后过滤,得到澄清溶液.对该溶液中溶质的组成,甲同学作出了推测溶液中溶质的组成甲同学认为是:NaCl、NaOH、Ca(OH)2和Na2CO3.
(1)乙同学认为甲同学的推测错误,其中甲同学推测错误的原因是(用化学方程式表示)______.
(2)乙同学为了进一步确定该溶液所有可能的组成,设计了以下实验.请填写表中所需的试剂,通过实验现象得出实验结论和该溶液中溶质可能的组成.
实验操作(填所加试剂的化学式) 实验现象 实验结论 该溶液中溶质的组成(填化学式) 用洁净的小试管取该溶液少许,加入______; 有气泡生成 ______ ______ 另用洁净的小试管取该溶液少许,加入______; 有白色沉淀生成 ______ ______ 上述两实验均无明显现象 ______ ______  w9xh31年前1
w9xh31年前1 -
 maggie_dandan 共回答了19个问题
maggie_dandan 共回答了19个问题 |采纳率94.7%解题思路:(1)碳酸钠可以和氢氧化钙溶液反应,所以它们不能共存于同一容器中,可以据此解答该题.
(2)根据原料生石灰、纯碱和食盐放入水中后,发生的一系列反应确定溶液中一定含有的成分;根据反应时过量物质的可能情况判断可能物还有碳酸钠或氢氧化钙,再根据二者的化学性质来判断是否含有二者中的哪一种或均不含有.(1)碳酸钠可以和氢氧化钙溶液反应,所以它们不能共存于同一容器中,该反应的化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(2)原料生石灰、纯碱和食盐放入水中后,生石灰和水反应生成熟石灰,熟石灰和纯碱反应生成碳酸钙沉淀和氢氧化钠,但氯化钠不再反应,所以溶液中一定有氯化钠和反应生成的氢氧化钠,如反应时熟石灰过量,则可能含有熟石灰,如纯碱过量,则可能含有纯碱;要证明是否有熟石灰或纯碱,可根据熟石灰能和碳酸钠反应生成碳酸钙沉淀的性质证明熟石灰的存在,可根据碳酸钠能和盐酸反应生成二氧化碳的性质来确定是否存在纯碱.
故答案为:(1)Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(2)
实验操作(填所加试剂的化学式) 实验现象 实验结论 该溶液中溶质的组成(填化学式)
用洁净的小试管取该溶液少许,加入 稀盐酸; 有气泡生成 有Na2CO3 NaOH、NaCl、Na2CO3
另用洁净的小试管取该溶液少许,加入 Na2CO3溶液; 有白色沉淀生成 有Ca(OH)2 NaOH、NaCl、Ca(OH)2
上述两实验均无明显现象 既无Na2CO3也无Ca(OH)2 NaOH、NaCl点评:
本题考点: 实验探究物质的组成成分以及含量;生石灰的性质与用途;盐的化学性质.
考点点评: 本题考查了酸碱盐之间的复分解反应以及碳酸盐的检验,完成此题,可以依据已有的知识结合物质的性质及相互间的反应进行.1年前查看全部
- 初3化学酸碱盐将一个洁净的鸡蛋放人玻璃杯中,因为杯口太窄,用手无法将鸡蛋放人杯中,正确的方法是?研究皮蛋壳外的物质,加适
初3化学酸碱盐
将一个洁净的鸡蛋放人玻璃杯中,因为杯口太窄,用手无法将鸡蛋放人杯中,正确的方法是?
研究皮蛋壳外的物质,加适量水搅拌,观察烧杯底部有白色固体,这固体可能是?
为研究上述烧杯中的溶液可能含有哪些物质
1A同学从烧杯中取少量溶液,加人HCL观察有无色气体生成,说话溶液中有?
2B同学从烧杯中取少量溶液,向其中加酚酞,溶液变红,于是认为使溶液呈碱性的就是NAOH等碱类物质,你认为此看法是否正确?理由?
3为证明溶液中含有KOH等碱类物质,设计一实验
 托内酷1年前2
托内酷1年前2 -
 kfwjl 共回答了17个问题
kfwjl 共回答了17个问题 |采纳率88.2%1、将杯底微热,气体受热膨胀,再把鸡蛋按在瓶口
2、CaCO3
3、有含碳酸根的物质,如CaCO3
4、不正确,如纯碱(Na2CO3)就不是碱,而是盐,但是呈碱性
5、加入铜离子(生成蓝色沉淀)或铁离子(生成红褐色沉淀)。1年前查看全部
- (2006•济宁)松花蛋又名皮蛋,微山湖出产的松花蛋因色味具佳享誉齐鲁.松花蛋的制作工艺一般是用水将灰料[主要是生石灰(
(2006•济宁)松花蛋又名皮蛋,微山湖出产的松花蛋因色味具佳享誉齐鲁.松花蛋的制作工艺一般是用水将灰料[主要是生石灰(CaO)、草木灰(成分中含K2CO3)、纯碱(Na2CO3)、食盐(NaCl)等]调成糊状,涂于新鲜鸭蛋,密封保存一段时间后,即可得到松花蛋.请根据以上信息回答:
①松花蛋腌制中发生的化学反应有______个;
②剥除松花蛋外边灰料后,常常发现蛋壳上有一些坚硬的白色斑点,这斑点的主要成分是______;
③食用劣质松花蛋时往往有麻涩感,可能的原因是______. 吴尊1年前1
吴尊1年前1 -
 fish7136 共回答了16个问题
fish7136 共回答了16个问题 |采纳率100%解题思路:①水能和氧化钙反应生成氢氧化钙,氢氧化钙能和碳酸钾反应生成碳酸钙和氢氧化钾,氢氧化钙能和碳酸钠反应生成碳酸钙和氢氧化钠;
②碳酸钙是一种不溶于水的白色固体,反应生成的白色固体碳酸钙附着在蛋壳上,会形成一些坚硬的白色斑点;
③显碱性的物质往往有涩味.①松花蛋腌制中发生的化学反应有:水能和氧化钙反应生成氢氧化钙,氢氧化钙能和碳酸钾反应生成碳酸钙和氢氧化钾,氢氧化钙能和碳酸钠反应生成碳酸钙和氢氧化钠.故填:3.
②松花蛋的制作过程中能够发生多个化学反应,其中有的反应能生成不溶于水的碳酸钙,碳酸钙是一种白色固体.故填:碳酸钙.
③食用劣质松花蛋时往往有麻涩感,可能的原因是灰料中碱性物质的成分过多.故填:灰料中碱性物质的成分过多.点评:
本题考点: 生石灰的性质与用途;氯化钠与粗盐提纯;碳酸钠、碳酸氢钠与碳酸钙.
考点点评: 本题主要考查的知识点是物质之间相互作用时的反应情况,解答时要充分理解复分解反应发生需要的条件,然后再判断反应能否发生.1年前查看全部
- 皮蛋的英语怎么说?字典里说的是preserved egg,但是昨晚的希望英语里说是100 years egg,到底哪个才
皮蛋的英语怎么说?
字典里说的是preserved egg,但是昨晚的希望英语里说是100 years egg,到底哪个才是准确的啊? 夏日雨加雪1年前7
夏日雨加雪1年前7 -
 yrdyjwx 共回答了19个问题
yrdyjwx 共回答了19个问题 |采纳率84.2%在美国这边的超级市场都翻译 1000 years egg1年前查看全部
- 为什么松花蛋(皮蛋)蛋清上上有羽毛状的东西?它是什么什么东西?怎么形成的?
 pangzi7201年前1
pangzi7201年前1 -
 aa员之父 共回答了18个问题
aa员之父 共回答了18个问题 |采纳率88.9%经过一场化学反应产生的:蛋白的主要化学成分是一种蛋白质.禽蛋放置的时间一长,蛋白中的部分蛋白质会分解成氨基酸.氨基酸知道吗?他的化学结构有一个碱性的氨基-NH2和一个酸性的羧基-COOH,因此它既能跟酸性物质作用又能跟碱性物质作用.所以人们在制造松花蛋设计,特意在泥巴里加入了一些碱性的物质,如石灰、碳酸钾、碳酸钠等.它们会穿过蛋壳上的细孔,与氨基酸化合,生成氨基酸盐.这些氨基酸盐不溶于蛋白,于是就以一定几何形状结晶出来,就形成了漂亮的松花.
其实它是松花图案 不是羽毛哟.1年前查看全部
- (2010•阜新)松花皮蛋是我们喜爱的食品.某小组同学查阅资料得知,制皮蛋料泥的原料主要是:生石灰、纯碱、草木灰(含K2
(2010•阜新)松花皮蛋是我们喜爱的食品.某小组同学查阅资料得知,制皮蛋料泥的原料主要是:生石灰、纯碱、草木灰(含K2CO3)等.同学们对料泥进行了如下探究:
[猜想]猜想I:料泥的主要成份是Ca(OH)2、NaOH、KOH、CaCO3、灰粉;
猜想Ⅱ:料泥的主要成份是NaOH、KOH、Na2CO3、CaCO3、灰粉.
[实验与现象]实验过程与现象如图: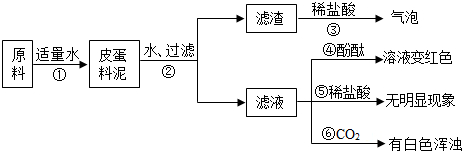
[问题与讨论]
(1)步骤②中所需要的玻璃仪器有:烧杯、玻璃棒、______,玻璃棒在步骤②中的一种作用______.
(2)步骤③的现象说明滤渣中含有:______(写化学式).
(3)请写出步骤①发生的任意两个反应的化学方程式:______、______.
(4)由上述实验现象推断,猜想______是正确的,其理由是______. splae1年前1
splae1年前1 -
 dsyyn 共回答了25个问题
dsyyn 共回答了25个问题 |采纳率88%解题思路:(1)过滤需要使用的仪器有:铁架台、漏斗、烧杯和玻璃棒;为防止液体倾倒时冲破滤纸,应使液体沿玻璃棒引入;
(2)滤渣加盐酸产生气体,固体物质可能是金属单质或碳酸盐;碳酸盐与盐酸反应,放出气体二氧化碳;
(3)生石灰为氧化钙的俗称,遇水生成氢氧化钙;氢氧化钙可与原料中的纯碱或草木炭发生反应生成碳酸钙沉淀和氢氧化钠、氢氧化钾;
(4)猜想II中的碳酸钠不发生反应残留在滤液中,当向滤液中滴加稀盐酸时会产生二氧化碳气体;若向猜想II的滤液中通入二氧化碳,氢氧化钠、氢氧化钾与二氧化碳反应不会出现沉淀.(1)步骤②需要进行过滤,过滤需要选择的玻璃仪器有漏斗、烧杯和玻璃棒;其中玻璃棒用于液体的引流,防止直接倾倒冲破滤纸;
故答案为:漏斗;引流;
(2)步骤③滴加盐酸观察到有气泡产生,结合猜想,滤渣中含碳酸盐,可判断滤渣中一定含有碳酸钙沉淀;
故答案为:CaCO3;
(3)原料中的生石灰与水反应生成氢氧化钙;氢氧化钙与纯碱、草木灰发生反应,生成碳酸钙沉淀和氢氧化钠、氢氧化钾;
故答案为:CaO+H2O═Ca(OH)2;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH或K2CO3+Ca(OH)2=CaCO3↓+2KOH;
(4)步骤⑤向滤液中滴加盐酸无气体产生,可说明滤液中不含量碳酸盐,而猜想II中的碳酸钠没有发生反应残留在滤液中,与实验现象不符;向滤液中通入二氧化碳出现白色沉淀,说明滤液中含有氢氧化钙,与猜想二不符;故猜想II不正确;
故答案为:I;步骤⑤无明显现象,说明料泥中无Na2CO3;步骤⑥白色浑浊,说明料泥中有Ca(OH)2.点评:
本题考点: 实验探究物质的组成成分以及含量;证明碳酸盐;常用仪器的名称和选用;生石灰的性质与用途;化学式的书写及意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 实验室检验CO32-的方法:滴加稀盐酸,产生气体通入澄清石灰水,石灰水变浑浊,说明含有碳酸根.1年前查看全部
- 篮子里有水煮蛋,茶蛋和皮蛋共30个,价值36元,已知水煮蛋每个0.9元,茶蛋每个1.5元,皮蛋每个1.8元.
篮子里有水煮蛋,茶蛋和皮蛋共30个,价值36元,已知水煮蛋每个0.9元,茶蛋每个1.5元,皮蛋每个1.8元.
问:篮子中皮蛋最多有多少个? maojuan1051年前1
maojuan1051年前1 -
 不肖子 共回答了13个问题
不肖子 共回答了13个问题 |采纳率92.3%设水煮蛋x 茶蛋y 皮蛋z
x+y+z=30;0.9x+1.5y+1.8z=36
27-0.9y-0.9z+1.5y+1.8z=36
0.9z+0.6y=9
3z+2y=30
z=(30-2y)/3
∵y和z都是整数
∴y=3,z=8,
∴x=19
检验:成立
所以最多8个1年前查看全部
- 初三化学科学疑问(急)某实验小组将制作皮蛋的原料生石灰、纯碱和食盐放入水中,充分反应后过滤,得到澄清溶液.对该溶液的组成
初三化学科学疑问(急)
某实验小组将制作皮蛋的原料生石灰、纯碱和食盐放入水中,充分反应后过滤,得到澄清溶液.对该溶液的组成,甲、乙同学分别作出以下推测:
甲:有食盐,还有反应生成的氢氧化钠和碳酸钙
乙:有氢氧化钠、氢氧化钙、碳酸钙和氯化钠
(1)上述两位同学的推测都有不足,理由是---------
(2)你的推测是:该溶液中一定存在的溶质是( )为进一步确定该溶液所有可能的组成,还需设计实验.请根据实验设计和操作填写下表
实验操作(填所有试剂的化学式) 实验现象 实验结论 该溶液的组成 gjv_sd5bq_t1c9_11年前1
gjv_sd5bq_t1c9_11年前1 -
 lzmaster 共回答了8个问题
lzmaster 共回答了8个问题 |采纳率100%碳酸钙是沉淀,已经被过滤掉了,不存在碳酸钙.
一定存在的是氯化钠,氢氧化钠,
可能存在的有,过量的碳酸钠,氢氧化钙,
去溶液少许,放入试管中,像是观众加入适量的盐酸,若有气泡,则存在碳酸钠,不存在氢氧化钙.则溶液组成为 氯化钠,氢氧化钠,碳酸钠.
再取溶液少许,通入二氧化碳,若产生沉淀,则有氢氧化钙,没有碳酸钠,
组成为 氯化钠,氢氧化钠,氢氧化钙.
若两个实验均无现象,则不存在 氢氧化钙和碳酸钠1年前查看全部
- 高中条件概率题1.大小均匀的5个鸡蛋中有3个红皮蛋、2个白皮蛋,每次取一个,无放回的取两次,求已知第一次取到红皮蛋的条件
高中条件概率题
1.大小均匀的5个鸡蛋中有3个红皮蛋、2个白皮蛋,每次取一个,无放回的取两次,求已知第一次取到红皮蛋的条件下,第二次也取到红皮蛋的概率.
2.六位同学参加百米短跑初赛,赛场共有6条跑道,已知甲同学排在第一跑道,则乙同学被排在第二跑道的概率是多少? huming19801年前2
huming19801年前2 -
 念珠草 共回答了18个问题
念珠草 共回答了18个问题 |采纳率88.9%1.无放回的取两次,所以 P(红|红)=(3-1)/(5-1)=1/2
2.P(乙在2道|甲在1道)=1/5(还有5条道可选,概率相等)1年前查看全部
- (2011•延庆县二模)某实验小组将制作皮蛋的原料生石灰、纯碱和食盐放入水中,充分反应后过滤,得到澄清溶液.对该溶液的组
(2011•延庆县二模)某实验小组将制作皮蛋的原料生石灰、纯碱和食盐放入水中,充分反应后过滤,得到澄清溶液.对该溶液的组成,甲、乙同学分别做出以下推测:
甲同学推测:有食盐,还有反应生成的氢氧化钠和碳酸钙.
乙同学推测:有氢氧化钠、氢氧化钙、碳酸钠和氯化钠.
(1)丙同学认为上述两位同学的推测都有不足,理由是______.
(2)丙同学的推测是:该溶液中一定存在的溶质是______.为进一步确定该溶液所有可能的组成,还需设计实验并填写下表(可不填满,也可补充).
实验操作
(填所加试剂的化学式)实验现象 实验结论 该溶液的组成 
______ ______ ______ 
______ ______ ______  suzhyy1年前1
suzhyy1年前1 -
 忠诚的qq教师 共回答了10个问题
忠诚的qq教师 共回答了10个问题 |采纳率90%解题思路:(1)根据碳酸钙不溶于水,氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠回答.
(2)根据原料生石灰、纯碱和食盐放入水中后,发生的一系列反应确定溶液中一定含有的成分;根据反应时过量物质的可能情况判断可能物还有碳酸钠或氢氧化钙,再根据二者的化学性质来判断是否含有二者中的哪一种或均不含有.(1)由于碳酸钙不溶于水,氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,所以甲、乙同学说法均错误.
(2)原料生石灰、纯碱和食盐放入水中后,生石灰和水反应生成熟石灰,熟石灰和纯碱反应生成碳酸钙沉淀和氢氧化钠,但氯化钠不再反应,所以溶液中一定有氯化钠和反应生成的氢氧化钠,如反应时熟石灰过量,则可能含有熟石灰,如纯碱过量,则可能含有纯碱;要证明是否有熟石灰或纯碱,可根据熟石灰能和碳酸钠反应生成碳酸钙沉淀的性质证明熟石灰的存在,可根据碳酸钠能和盐酸反应生成二氧化碳的性质来确定是否存在纯碱.
故答案为:
(1)甲同学没有考虑过滤时已将碳酸钙除去;乙同学没有考虑溶液中氢氧化钙与碳酸钠不能共存
(2)NaOH、NaCl
实验操作 实验现象 实验结论 该溶液的组成
HCl 有气泡生成 有Na2CO3 NaOH、NaCl、Na2CO3
Na2CO3 有白色沉淀生成 有Ca(OH)2 NaOH、NaCl、Ca(OH)2
上述两实验均无明显现象 既无Na2CO3也无Ca(OH)2 NaOH、NaCl点评:
本题考点: 酸、碱、盐的鉴别;酸碱盐的溶解性;离子或物质的共存问题.
考点点评: 综合实验既考查知识的识记、理解、迁移、运用,又考查分析、对比、归纳等思维能力,符合素质教育培养学生能力的要求,是中考方向,对这类题目要重点训练,特别是对实验的设计和评价,更是重中之重.该题对常见的碱Ca(OH)2、常见的盐Na2CO3的性质必须烂熟于心,才能对灵活多变的题目应付自如.因此平时要多注意对基础知识的牢固掌握和对知识的灵活运用.1年前查看全部
- 皮蛋制作的化学反应顺序
 667465331年前1
667465331年前1 -
 17423 共回答了14个问题
17423 共回答了14个问题 |采纳率78.6%皮带制作是氢氧化钙和氢氧化钠、黄丹氧化铅是蛋白质变性的过程.1年前查看全部
- (2011•綦江县)纸包皮蛋是一项新技术,制作过程中需要配制料液.某配方料液中含NaOH、NaCl、红茶末、五香粉等,技
(2011•綦江县)纸包皮蛋是一项新技术,制作过程中需要配制料液.某配方料液中含NaOH、NaCl、红茶末、五香粉等,技术员先配得NaOH、NaCl的混合液2400g,其中含80gNaOH,81gNaCl.计算:
(1)混合液中NaOH的质量分数.
(2)如果取24g混合液,加入一定质量3.65%的稀盐酸恰好完全反应,计算所加稀盐酸的质量.
(3)24g混合液与稀盐酸反应后所得溶液中NaCl的质量分数. yhsmkj1年前1
yhsmkj1年前1 -
 纳米天下 共回答了9个问题
纳米天下 共回答了9个问题 |采纳率66.7%解题思路:(1)已知NaOH的质量和混合液的质量根据溶质的质量分数的计算公式
×100%可求出混合液中NaOH的质量分数溶质的质量 溶液的质量
(2)稀盐酸能与氢氧化钠反应根据氢氧化钠的质量和化学方程式可求出所加稀盐酸的质量
(3)根据氢氧化钠的质量和化学方程式可求出生成的氯化钠的质量,与混合液中的氯化钠的质量之和为溶质质量;(l)混合溶液中氢氧化钠的质量分数为 [80g/2400g×100%═3.3%
(2)设需要稀盐酸的质量为x,生成NaCl的质量为y
NaOH+HCl═H2O+NaCl
40 36.5 58.5
80g÷2400g×24g3.65%×x y
40
80g÷2400g×24g=
36.5
3.65%×x=
58.5
y]
X═20gy═1.17g
(3)24g混合液与稀盐酸反应后所得溶液中NaCl的质量分数为
1.17g+81g÷2400g×24g
24g+20g× 100%═4.5%
答:(l)混合溶液中氢氧化钠的质量分数为3.3%
(2)设需要稀盐酸的质量为20g
(3)24g混合液与稀盐酸反应后所得溶液中NaCl的质量分数为4.5%点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 根据化学方程式进行计算时,所使用的均为纯净物的质量,不要把稀盐酸质量50g当作HCl质量代入计算1年前查看全部
- 篮子里有煮蛋,茶叶蛋和皮蛋共30个,价值24元钱,已知煮蛋每个0.60元钱,茶叶蛋每个1元钱,皮蛋每个1.20
篮子里有煮蛋,茶叶蛋和皮蛋共30个,价值24元钱,已知煮蛋每个0.60元钱,茶叶蛋每个1元钱,皮蛋每个1.20
问篮子里最多有多少皮蛋!!急!!!!
还要过程!!明确的!! skv3gh1年前4
skv3gh1年前4 -
 vivipeggy 共回答了18个问题
vivipeggy 共回答了18个问题 |采纳率88.9%x,y,z
x+y+z=30
y=30-x-z
0.6x+1y+1.2z=24
0.6x+30-x-z+1.2z=24
0.4x-0.2z=6
z=4x-60(x,z为>=0且1年前查看全部
- 皮蛋外皮中含有纯碱、熟石灰等物质,反应后生成一种有涩味的强碱,写出生成该强碱的化学方程式,为咯去除皮蛋中的涩味,可加入适
皮蛋外皮中含有纯碱、熟石灰等物质,反应后生成一种有涩味的强碱,写出生成该强碱的化学方程式,为咯去除皮蛋中的涩味,可加入适量的什么
 梦幻之舟1年前3
梦幻之舟1年前3 -
 绿环邻女 共回答了1个问题
绿环邻女 共回答了1个问题 |采纳率100%醋酸1年前查看全部
- 篮子里有煮蛋,茶蛋和皮蛋共30个,价值24元,已知煮蛋每个0.6元,茶蛋每个1.00元,皮蛋每个1.20元,问篮子
篮子里有煮蛋,茶蛋和皮蛋共30个,价值24元,已知煮蛋每个0.6元,茶蛋每个1.00元,皮蛋每个1.20元,问篮子
中最多有几个皮蛋? 春最珍贵1年前1
春最珍贵1年前1 -
 lawyy 共回答了19个问题
lawyy 共回答了19个问题 |采纳率89.5%设篮子里有煮蛋X个,茶蛋Y个,皮蛋Z个 且X、Y、Z均不为0
x+y+z=30 (1)
0.6x+y+1.2z=24 (2)
(1)式化简得y=30-x-z
带入(2)整理得
2x-z=30
做一个2元1次线曲线图,看两条曲线的里面的最小值,这个就是我们要的最小值.1年前查看全部
- 腌制皮蛋的配料用水调制时,主要发生的化学方程式有?
腌制皮蛋的配料用水调制时,主要发生的化学方程式有?
(不考虑粘土物质可能参与反应)
有两个 patoct1年前2
patoct1年前2 -
 sprincc 共回答了20个问题
sprincc 共回答了20个问题 |采纳率95%什么金太阳团队?
连沉淀符号都打不出来?
Na2CO3+Ca(OH)2=====CaCO3↓+2NaOH1年前查看全部
- Think and write.写出反义词,我是帅皮蛋!有不懂的到这来!英语问题多又多!
 394473081年前2
394473081年前2 -
 dj1234 共回答了22个问题
dj1234 共回答了22个问题 |采纳率90.9%small short cold warm thas black thin there1年前查看全部
- 篮子里有煮蛋,茶叶蛋和皮蛋共30个,价值24元钱,已知煮蛋每个0.60元钱,茶叶蛋每个1元钱,皮蛋每个1.20.
篮子里有煮蛋,茶叶蛋和皮蛋共30个,价值24元钱,已知煮蛋每个0.60元钱,茶叶蛋每个1元钱,皮蛋每个1.20.
问篮子里最多有多少皮蛋? beynson1年前1
beynson1年前1 -
 crinum 共回答了20个问题
crinum 共回答了20个问题 |采纳率90%10个1年前查看全部
- 腌制皮蛋常常用熟石灰和纯碱作原料,因此使用时常常带有涩味,下列食品中可以除去这种涩味的是
腌制皮蛋常常用熟石灰和纯碱作原料,因此使用时常常带有涩味,下列食品中可以除去这种涩味的是
A.食用油 B.食醋.C.小苏打 D.食盐 孤独不孤1年前1
孤独不孤1年前1 -
 简单_粗暴 共回答了13个问题
简单_粗暴 共回答了13个问题 |采纳率100%选B,用熟石灰和纯碱作原料,食用时常常带有涩味,说明是熟石灰和纯碱造成的,用试剂反应消除这两种物质即可.
A.不反应
B.2CH3COOH+Ca(OH)2=(CH3COO)2Ca+2H2O
2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑
C.NaHCO3是碱性的,不能中和
D.NaCl不反应1年前查看全部
- (2005•甘肃)为了探究皮蛋中的化学知识,同学们找来一包皮蛋加工配料,经过查找资料得知皮蛋加工配料的主要成分是氧化钙、
(2005•甘肃)为了探究皮蛋中的化学知识,同学们找来一包皮蛋加工配料,经过查找资料得知皮蛋加工配料的主要成分是氧化钙、纯碱和食盐,为了验证皮蛋加工配料的主要成分,他们进行了如下实验:
取少量配料于小烧杯中,并向其中加入足量的水,搅拌、静置、过滤.过滤后得到白色固体为______,它们在水中发生反应的化学方程式为______,______.滤液中一定存在的溶质是______,如果反应物没有恰好完全反应,滤液中还可能存在的溶质是______或______.
为了进一步确定滤液中可能存在的物质,他们设计了如下实验,请你帮助他们完善:
你认为是否仍需进行实验?______(填“是”或“否”),理由是______.实验步骤 实验现象 实验结论 取一支试管,倒入少量滤液,往其中滴加稀盐酸 若有气泡产生 ______ 若无气泡产生 ______  我们一定成功51年前1
我们一定成功51年前1 -
 琰雨幻 共回答了17个问题
琰雨幻 共回答了17个问题 |采纳率94.1%解题思路:在该过程中发生了CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH两个反应,因此滤液中一定有生成的氢氧化钠,氢氧化钙和碳酸钠最多只能含有一种,由于题意中已明确说明反应物没有恰好完全反应,即反应物有剩余,即有氢氧化钙或者有碳酸钠.由于这三种物质溶于水时发生的反应有CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,因此过滤后的白色固体是碳酸钙,滤液中一定有生成的氢氧化钠和氯化钠,如果反应物没有恰好完全反应,则可能有氢氧化钙和碳酸钠中的一种,往滤液中滴加稀盐酸,若有气泡,说明有碳酸钠;若没有气泡,说明没有碳酸钠,有氢氧化钙.
故答案为:
碳酸钙,CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,NaOH和NaCl,Ca(OH)2,Na2CO3;
①有碳酸钠、没有氢氧化钙;②没有碳酸钠、有氢氧化钙;
否,滤液中可能存在的物质已确定.点评:
本题考点: 实验探究物质的组成成分以及含量;碱的化学性质;碳酸钠、碳酸氢钠与碳酸钙.
考点点评: 主要考查了物质间的反应规律、复分解反应的条件和有关物质的检验,培养学生分析问题、应用知识解决问题的能力.1年前查看全部
- 松花蛋又名皮蛋,微山湖出产的松花蛋因色味具佳享誉齐鲁.松花蛋的制作工艺一般是用水将灰料[主要是生石灰(CaO)、草木灰(
松花蛋又名皮蛋,微山湖出产的松花蛋因色味具佳享誉齐鲁.松花蛋的制作工艺一般是用水将灰料[主要是生石灰(CaO)、草木灰(成分中含K2CO3)、纯碱(Na2CO3)、食盐(NaCl)等]调成糊状,涂于新鲜鸭蛋,密封保存一段时间后,即可得到松花蛋.请根据以上信息回答:
①松花蛋腌制中发生的化学反应有______个;
②剥除松花蛋外边灰料后,常常发现蛋壳上有一些坚硬的白色斑点,这斑点的主要成分是______;
③食用劣质松花蛋时往往有麻涩感,可能的原因是______. 蓝色_波尔卡1年前4
蓝色_波尔卡1年前4 -
 鱼儿游110 共回答了20个问题
鱼儿游110 共回答了20个问题 |采纳率75%解题思路:①水能和氧化钙反应生成氢氧化钙,氢氧化钙能和碳酸钾反应生成碳酸钙和氢氧化钾,氢氧化钙能和碳酸钠反应生成碳酸钙和氢氧化钠;
②碳酸钙是一种不溶于水的白色固体,反应生成的白色固体碳酸钙附着在蛋壳上,会形成一些坚硬的白色斑点;
③显碱性的物质往往有涩味.①松花蛋腌制中发生的化学反应有:水能和氧化钙反应生成氢氧化钙,氢氧化钙能和碳酸钾反应生成碳酸钙和氢氧化钾,氢氧化钙能和碳酸钠反应生成碳酸钙和氢氧化钠.故填:3.
②松花蛋的制作过程中能够发生多个化学反应,其中有的反应能生成不溶于水的碳酸钙,碳酸钙是一种白色固体.故填:碳酸钙.
③食用劣质松花蛋时往往有麻涩感,可能的原因是灰料中碱性物质的成分过多.故填:灰料中碱性物质的成分过多.点评:
本题考点: 生石灰的性质与用途;氯化钠与粗盐提纯;碳酸钠、碳酸氢钠与碳酸钙.
考点点评: 本题主要考查的知识点是物质之间相互作用时的反应情况,解答时要充分理解复分解反应发生需要的条件,然后再判断反应能否发生.1年前查看全部
- 皮 蛋的主要成分是氧化钙,纯碱,食盐.为了验证皮蛋加工配料的主要成分,做了如下实验:
皮 蛋的主要成分是氧化钙,纯碱,食盐.为了验证皮蛋加工配料的主要成分,做了如下实验:
取少量配料放入小烧杯中,加入足量的水,搅拌,静置,过滤.最后得到的白色固体为____,他们在水中发生反应的化学方程式:
_________ _______
滤液中一定存在的溶质是____,如果反应物没有恰好反应,滤液中还可能存在的溶质是_____或____
能说下最后三个空格的原因吗? ekinig1231年前1
ekinig1231年前1 -
 暗夜光芒 共回答了22个问题
暗夜光芒 共回答了22个问题 |采纳率77.3%1.CaCO3
2.CaO+H2O+NaCO3=CaCO3↓+2NaOH
3.NaCl和NaOH
4.Ca(OH)2
5.NaCO3
因为上面写的那个反应会生成NaOH,而且本来就有NaCl(不跟什么反应,所以还在)
如果上面的反应是CaO过量,就还会有Ca(OH)2
如果是NaCO3过量,就还有Na2CO31年前查看全部
- 检验皮蛋中氧化钙,纯碱,食盐过滤后的白色固体是?滤液中加稀盐酸,有气泡的是什么?
 森林青草1年前2
森林青草1年前2 -
 kawailling 共回答了16个问题
kawailling 共回答了16个问题 |采纳率75%CAO+H2O=CA(OH)2
Ca(OH)2+Na2CO3=2NaOH+CaCO3
白色是CACO3
如果+HCL有气泡是反应未完的Na2CO3生成的CO21年前查看全部
- 皮蛋加工过程中的化学方程式加工皮蛋用料是氧化钙,食盐,纯碱最后溶液里的溶剂是什么,如果没有完全反映滤液中可能有的溶剂是什
皮蛋加工过程中的化学方程式
加工皮蛋用料是氧化钙,食盐,纯碱
最后溶液里的溶剂是什么,如果没有完全反映滤液中可能有的溶剂是什么、?快快快!!! kolo88881年前1
kolo88881年前1 -
 hh 共回答了24个问题
hh 共回答了24个问题 |采纳率91.7%CaO+H2O=Ca(OH)2
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
Ca(OH)2+K2CO3= CaCO3↓+2KOH1年前查看全部
- 火焰原子吸收光谱法测皮蛋中铅的含量具体步骤
火焰原子吸收光谱法测皮蛋中铅的含量具体步骤
能不能更细致点呢, cocicy1年前1
cocicy1年前1 -
 tuboxcm 共回答了23个问题
tuboxcm 共回答了23个问题 |采纳率91.3%1.消解,制样.
2.上机,读数.
3.记录.分析.1年前查看全部
- 为了探究皮蛋中的化学知识,同学们找来一包皮蛋加工配料,经过查找资料得知皮蛋加工配料的主要成分是氧化钙、纯碱和食盐.为了验
为了探究皮蛋中的化学知识,同学们找来一包皮蛋加工配料,经过查找资料得知皮蛋加工配料的主要成分是氧化钙、纯碱和食盐.为了验证皮蛋加工配料的主要成分,他们进行了如下实验:
取少量配料于小烧杯中,并向其中加入足量的水,搅拌、静置、过滤.过滤后得到的白色固体为______.它们在水中发生反应的化学方程式为______.
滤液中一定存在的溶质是______,如果反应物没有恰好完全反应,滤液中还可能存在的溶质是______或______.
为了进一步确定滤液中可能存在的物质,他们设计了如下实验,请你帮助他们完善:
实验步骤 实验现象 实验结论 取一支试管,倒入少量滤液,往其中滴加稀盐酸 若有气泡产生
______若无气泡产生 ______  ht9kk1年前1
ht9kk1年前1 -
 tdycom 共回答了13个问题
tdycom 共回答了13个问题 |采纳率84.6%解题思路:根据在该过程中发生了CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH两个反应,因此滤液中一定有生成的氢氧化钠,氢氧化钙和碳酸钠最多只能含有一种,由于题意中已明确说明反应物没有恰好完全反应,即反应物有剩余,即有氢氧化钙或者有碳酸钠进行分析.由于这三种物质溶于水时发生的反应有CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,因此过滤后的白色固体是碳酸钙,滤液中一定有生成的氢氧化钠和氯化钠,如果反应物没有恰好完全反应,则可能有氢氧化钙和碳酸钠中的一种,向滤液中滴加稀盐酸,若有气泡,说明有碳酸钠;若没有气泡,说明没有碳酸钠,有氢氧化钙,
实验步骤 实验现象 实验结论
有碳酸钠,没有氢氧化钙
没有碳酸钠,有氢氧化钙 故答案为:碳酸钙;CaO+H2O=Ca(OH)2、Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;NaOH和NaCl;Ca(OH)2,Na2CO3;
实验步骤 实验现象 实验结论
有碳酸钠,没有氢氧化钙
没有碳酸钠,有氢氧化钙点评:
本题考点: 盐的化学性质;生石灰的性质与用途;酸的化学性质.
考点点评: 此类题要考查了物质间的反应规律、复分解反应的条件和有关物质的检验,培养学生分析问题、应用知识解决问题的能力.1年前查看全部
大家在问
- 1下列各组物质相互混合反应后,最终有白色沉淀生成的是
- 2(2011•镇江三模)某小组同学研究有关杠杆平衡的问题,他们在已调节水平平衡的杠杆上,用弹簧测力计、钩码分别进行实验,研
- 3词汇题 3题,下学期读初三了,有些初一初二的单词一时间想不起来.
- 4连词成句 1. think,is,there,in,zoo,new,i
- 5小刚家里养了7只鸡,共生蛋35个.已知每只母鸡生7个蛋,这些鸡中有几只
- 6已知抛物线y2=4x,椭圆x29+y2m=1有共同的焦点F2
- 7急要!带花字的成语,四个字的词也可.形容思想方面的,褒义词.
- 8下面是希望小学三年级、四年级、五年级三个年级学生做好事情况统计图.三年级做好事的人数占三个年级做好事
- 9(2011•成都一模)(1+1x)6的展开式中1x2的系数为( )
- 10“天王”用英文怎么说?
- 11把下面的小数分别填入适当的方框里.
- 12成功的门虚掩着 作文
- 13三氧化铬是几价铬,氧的数量与价态的关系是什么呢?
- 14原价满200减100和原价上打五折哪个便宜
- 15李悝读音战国初期魏国著名政治家李悝悝读音kui还是li
